题目内容
20.有一混合物水溶液,含有以下离子中的若干种:Na+、NH4+、Cl-、Ba2+、HCO3-、SO42-,现各取100mL溶液分别进行如下实验:①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
③第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-:否;(填“是”或“否”)
(2)由第二份进行的实验可知混合物中应含有NH4+离子,其物质的量浓度为0.2mol/L;
(3)由第三份进行的实验可知4.30g沉淀的成份为BaCO3、BaSO4,写出生成该沉淀的离子方程式:Ba2++HCO3-+OH-=BaCO3↓+H2O、Ba2++SO42-=BaSO4↓;
(4)溶液中肯定存在的离子是Na+、NH4+、HCO3-、SO42-.
分析 ①第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、SO42-;
②第二份溶液加足量NaOH溶液加热后收集到气体,推得一定含有NH4+,且n(NH4+)=n(NH3)=$\frac{0.448L}{22.4L/mol}$=0.02mol;
③第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g,
可知BaSO4为2.33g,物质的量为0.01mol,BaCO3为4.30g-2.33g═1.97g,物质的量为0.01mol,根据原子守恒,所以100mL该溶液中含0.1mol HCO3-,则HCO3-物质的量为0.01mol,因含有SO42-,则一定不存在Ba2+,
根据溶液中阴阳离子的电荷守恒,即可推出Na+一定存在,以此解答该题.
解答 解:①第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、SO42-;
②第二份溶液加足量NaOH溶液加热后收集到气体,推得一定含有NH4+,且n(NH4+)=n(NH3)=$\frac{0.448L}{22.4L/mol}$=0.02mol;
③第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g,
可知BaSO4为2.33g,物质的量为0.01mol,BaCO3为4.30g-2.33g═1.97g,物质的量为0.01mol,根据原子守恒,所以100mL该溶液中含0.1mol HCO3-,则HCO3-物质的量为0.01mol,因含有SO42-,则一定不存在Ba2+,
根据溶液中阴阳离子的电荷守恒,即可推出Na+一定存在,
(1)第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、SO42-,不能确定是否含有氯离子,故答案为:否;
(2)第二份溶液加足量NaOH溶液加热后收集到气体,推得一定含有NH4+,且n(NH4+)=n(NH3)=$\frac{0.448L}{22.4L/mol}$=0.02mol,则物质的量浓度为$\frac{0.02mol}{0.1L}$=0.2 mol/L,
故答案为:NH4+;0.2 mol/L;
(3)第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g,可知BaSO4为2.33g,物质的量为0.01mol,BaCO3为4.30g-2.33g═1.97g,物质的量为0.01mol,发生反应HCO3-+Ba2++OH-═BaCO3↓+H2O、SO42-+Ba2+═BaSO4↓,
故答案为:BaCO3、BaSO4;Ba2++HCO3-+OH-=BaCO3↓+H2O、Ba2++SO42-=BaSO4↓;
(4)由以上分析可知一定含有Na+、NH4+、HCO3-、SO42-.故答案为:Na+、NH4+、HCO3-、SO42-.
点评 本题考查无机物的推断,为高频考点,侧重于学生分析、实验和计算能力的考查,题目采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是钠离子的确定易出现失误.

 名校课堂系列答案
名校课堂系列答案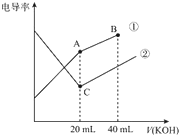
| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 | |
| B. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| C. | 漂白粉在空气中变质是因为CaCl2与空气中的CO2反应生成 CaCO3 | |
| D. | 用热的纯碱溶液洗去油污是因为Na2CO3可直接与油脂反应 |
| A. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| B. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 医用酒精是利用了乙醇的氧化性来杀菌消毒的 |
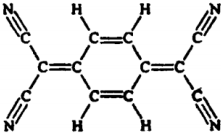
| A. | 分子中所有的氮原子在同一平面内 | B. | 属于芳香烃 | ||
| C. | 分子式为C12H4N4 | D. | 该物质易溶于水 |
| A. | Na2O2固体(稀硫酸) | B. | FeCl2溶液(KSCN溶液) | ||
| C. | KI固体(淀粉溶液) | D. | NaOH溶液(盐酸) |