题目内容
19.下列叙述中,指定粒子的数目约为6.02×1023的是( )| A. | 1.6gCH4中含有的分子数 | |
| B. | 100 mL1mol/LH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下,22.4LCO气体中含有的分子数 |
分析 A.依据n=$\frac{m}{M}$质量转化为物质的量;
B.根据物质的量浓度公式n=CV计算;
C.依据n=$\frac{m}{M}$质量转化为物质的量;
D.依据n=$\frac{V}{Vm}$计算.
解答 解:A.1.6 g CH4物质的量为$\frac{1.6g}{16g/mol}$=0.1mol,含有6.02×1022个分子,故A错误;
B.根据物质的量浓度公式:n(硫酸)=c•v=1 mol/L×0.1L=0.1mol,所以n(H+)=0.2mol,氢离子数目为1.204×1023,故B错误;
故B错误;
C.2.4gMg物质的量为$\frac{2.4g}{24g/mol}$=0.1mol,含有的原子数,6.02×1022个,故C错误;
D.标准状况下,22.4LCO气体物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,含有的分子数6.02×1023,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,明确好以物质的量为中心的各化学量与阿伏加德罗常数的关系为解答关键,题目较简单.

练习册系列答案
相关题目
9.在下列元素中,其非金属性最强的元素是( )
| A. | O | B. | F | C. | S | D. | Cl |
11.电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.右图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是 ( )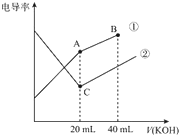

| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
8.以下说法正确的是( )
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 | |
| B. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| C. | 漂白粉在空气中变质是因为CaCl2与空气中的CO2反应生成 CaCO3 | |
| D. | 用热的纯碱溶液洗去油污是因为Na2CO3可直接与油脂反应 |

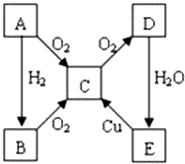 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.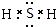 ;
; CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O. ;
;
