题目内容
15.银氨溶液可用于检测CO气体,实验室研究的装置如图: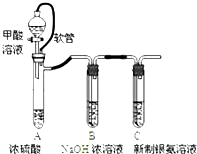 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
(2)装置A中软管的作用是平衡漏斗上下压强,使甲酸溶液能顺利滴下.
(3)为验证C中上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3(填化学式).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为10.8g.
分析 (1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,C元素的化合价不变,甲酸脱水;
(2)A中软管可使下方生成的气体的气压转移到液体的上方;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,与b对比;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中反应生成碳酸铵;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,遵循电子守恒.
解答 解:(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,C元素的化合价不变,甲酸脱水,则体现浓硫酸的脱水性,
故答案为:脱水;
(2)A中软管可使下方生成的气体的气压转移到液体的上方,即其作用为恒压,使甲酸溶液能顺利滴下,
故答案为:平衡漏斗上下压强,使甲酸溶液能顺利滴下;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,为b、c的对比试验,排除银氨溶液对产物检验的干扰,
故答案为:对比试验,排除银氨溶液对产物检验的干扰;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中HCOOH与银氨溶液反应生成碳酸铵,所以上层清液中产物成分为(NH4)2CO3,
故答案为:(NH4)2CO3;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮,则证明黑色固体的成分是Ag的方法为取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银,
故答案为:滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵,该离子反应为[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O,
故答案为:[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,消耗3.3g羟氨,n(NH2OH)=$\frac{3.3g}{33g/mol}$=0.1mol,由电子守恒可知,理论上可得银的质量为$\frac{0.1mol-[0-(-1)]}{1-0}$×108g/mol=10.8g,故答案为:10.8.
点评 本题考查性质实验方案的设计,为高频考点,把握甲酸中含-CHO与银氨溶液的反应及产物的检验设计为解答的关键,侧重分析能力、计算能力及实验能力的综合考查,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,若H的一种同位素中子数为5,则其原子符号是${\;}_{5}^{10}$B,B元素的原子结构示意图是
 ;
;(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物F2A2的电子式是:
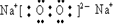 .
.(3)用电子式表示F2I的形成过程:
 ;
;(4)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则乙极的电极反应式为:O2+4e-+2H2O=4OH-.
| 选项 | 实验操作 | 现象 | 结论 |
| A | NH4HSO3受热分解产生的气体全部通入Ba(NO3)2溶液中 | 产生白色沉淀 | 沉淀为BaSO4 |
| B | 浓度均为0.1mol•L-1Zn2+和Cu2+混合溶液中滴入少量Na2S溶液 | 产生黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 2mLpH=3的盐酸和2mLpH=3醋酸,同时分别加入足量相同的锌粉 | 反应速率不同 | 较快的为盐酸 |
| D | 待测液X中加入KSCN溶液无明显现象,加入H2O2酸性溶液 | 溶液变为红色 | X中含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
| A. |  实验室制氧气 | B. |  收集氧气 | ||
| C. |  制备并检验氢气的可燃性 | D. |  浓硫酸稀释 |
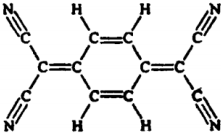
| A. | 分子中所有的氮原子在同一平面内 | B. | 属于芳香烃 | ||
| C. | 分子式为C12H4N4 | D. | 该物质易溶于水 |
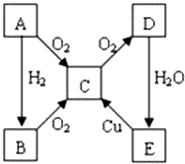 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.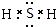 ;
; CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O.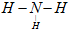 ;
;