题目内容
2.25℃时某溶液中OH-的浓度是H+浓度的10000倍,该溶液的pH为( )| A. | 5 | B. | 8 | C. | 9 | D. | 13 |
分析 设该溶液中氢离子浓度为x,则氢氧根离子的浓度为10000x,然后结合常温下水的离子积Kw=c(H+)•c(OH-)=10-14列式计算出氢离子浓度,最后利用pH=-lgc(H+)计算出该溶液的pH.
解答 解:设该溶液中氢离子浓度为x,则氢氧根离子的浓度为10000x,
则常温下Kw=c(H+)•c(OH-)=10000x2=10-14,
解得:x=10-9mol/L,
所以该溶液的pH=-lg10-9=9,
故选C.
点评 本题考查了溶液pH的简单计算,题目难度不大,明确溶液中氢离子浓度与溶液pH的关系为解答关键,注意掌握常温下水的离子积,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
12.下列各组物质按氧化物、酸、碱、盐的顺序排列正确的是( )
| A. | MgO、H2SO4、Na2O、CaCl2 | B. | MnO2、HNO3、KOH、K2CO3 | ||
| C. | SO2、NaHSO4、Ca(OH)2、KCl | D. | CH3OH、CH3COOH、C2H5OH、CH4 |
13.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和C(金刚石) | B. | CO2和H2 | C. | NaCl和HCl | D. | MgCl2和KCl |
10.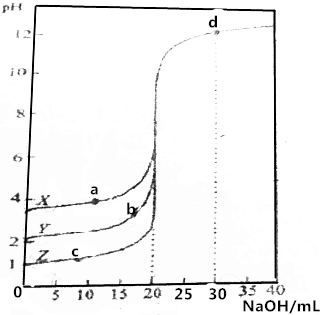 用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )
用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )
 用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )
用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )| A. | Z为一元强酸 | |
| B. | d点的c(OH-)为0.02000mol•L-1 | |
| C. | a、b、c中b点的阴离子的物质的量浓度最大 | |
| D. | X、Y为一元弱酸,且其电离常数:Ka(x)<Ka(Y) |
17.下列溶液中H+的浓度相同,则其物质的物质的量浓度最大的是( )
| A. | HCL | B. | HI | C. | HF | D. | H2SO4 |
7.下列有关“燃烧”的叙述不正确的是( )
| A. | 燃烧是发光、发热的化学反应 | B. | 燃烧必须有02参加 | ||
| C. | 燃烧必须有H20参加 | D. | 燃烧一定是氧化还原反应 |
14.下列化合物中不含双键结构的是( )
| A. | 乙醇 | B. | 二氧化碳 | C. | 乙酸 | D. | 乙醛 |
15.在一固定体积的密闭容器中加入2mol A和1mol B发生反应2A(g)+B(g)?4C(g)+D(s),达到平衡时C的浓度为w mol•L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol•L-1的配比是( )
| A. | 4 molA+2 molB | |
| B. | 4 mol C+1 molD+2mol A+1 mol B | |
| C. | 1.6mol C+0.3 molD+1.2mol A+0.6 mol B | |
| D. | 4 mol C+0.8molD |
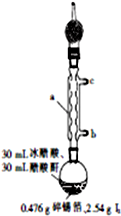 四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下: