题目内容
14.下列化合物中不含双键结构的是( )| A. | 乙醇 | B. | 二氧化碳 | C. | 乙酸 | D. | 乙醛 |
分析 根据物质书写有机物的结构,根据有机物的结构进行判断.
解答 解:A.乙醇为CH3CH2OH,分子中只含有单键,故A符合;
B.二氧化碳为O=C=O,存在C=O双键,故B不符合;
C.乙酸为 ,含有C=O双键,故C不符合;
,含有C=O双键,故C不符合;
D.乙醛为 ,含有C=O双键,故D不符合;
,含有C=O双键,故D不符合;
故选A.
点评 本题考查有机物的结构,比较基础,根据物质写出有机物的结构简式或结构式是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)?C(g)+D(g)当下列物理量不再变化时,不能表明反应已达平衡的是( )
| A. | 混合气体的物质的量 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | 固体A的质量 |
5.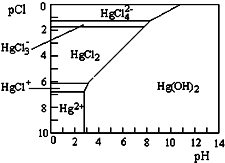 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )| A. | 正常海水(Cl-的浓度大于0.1mol•L-1)中汞元素的主要存在形态是HgCl42- | |
| B. | 少量Hg(NO3)2溶于0.001mol•L-1的盐酸后,汞元素的主要存在形态是HgCl2 | |
| C. | 将Hg(NO3)2固体直接溶于水中配制溶液 | |
| D. | 可用废铜屑处理含Hg2+的废水,其离子方程式为Cu+Hg2+═Cu2++Hg |
2.25℃时某溶液中OH-的浓度是H+浓度的10000倍,该溶液的pH为( )
| A. | 5 | B. | 8 | C. | 9 | D. | 13 |
9.对于有气体参加的化学反应,下列说法正确的是( )
| A. | 增大压强,活化分子百分数增大,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率一定增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
2.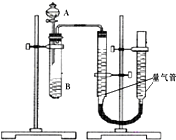 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
(1)该实验的目的是探究草酸浓度和催化剂对化学反应速率的影响.
(2)分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
(4)X=A
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4溶液过量.
 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(2)分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/ml | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4溶液过量.
9.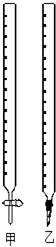 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
回答下列问题:
(1)如图中甲为酸式滴定管,乙为碱式 滴定管(填“酸式”或“碱式”)
(2)实验中,需要润洗的仪器是:(酸、碱式)滴定管
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂.滴定终点的判断依据是红色褪去,半分钟不再出现红色
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果偏高
(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果偏低.
(5)未知浓度的NaOH溶液的物质的量浓度为0.1288 mol/l.
 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
(1)如图中甲为酸式滴定管,乙为碱式 滴定管(填“酸式”或“碱式”)
(2)实验中,需要润洗的仪器是:(酸、碱式)滴定管
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂.滴定终点的判断依据是红色褪去,半分钟不再出现红色
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果偏高
(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果偏低.
(5)未知浓度的NaOH溶液的物质的量浓度为0.1288 mol/l.
6.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
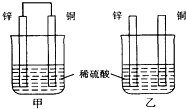

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |
7.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使甲基橙溶液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- |