题目内容
17.下列溶液中H+的浓度相同,则其物质的物质的量浓度最大的是( )| A. | HCL | B. | HI | C. | HF | D. | H2SO4 |
分析 强酸为强电解质完全电离,弱酸为弱电解质,部分电离,氯化氢、碘化氢、硫酸都是强电解质,氟化氢为弱电解质,据此解答.
解答 解:HCl、HI、H2SO4为强酸,完全电离,HF为弱酸,部分电离,则H+相同时HF溶液中含有大量的未电离的HF分子,因此HF的物质的量浓度最大,
故选:C.
点评 本题考查了弱电解质的电离,题目难度中等,明确强弱电解质的电离特点为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.下列叙述正确的是( )
| A. | S2-的结构示意图是 | B. | HCl 的电子式为H+[:Cl:]- | ||
| C. | H2O的结构式为H-O-H | D. | 还原性:HCl>H2S |
5.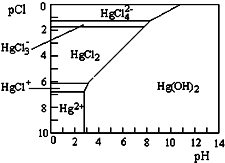 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )| A. | 正常海水(Cl-的浓度大于0.1mol•L-1)中汞元素的主要存在形态是HgCl42- | |
| B. | 少量Hg(NO3)2溶于0.001mol•L-1的盐酸后,汞元素的主要存在形态是HgCl2 | |
| C. | 将Hg(NO3)2固体直接溶于水中配制溶液 | |
| D. | 可用废铜屑处理含Hg2+的废水,其离子方程式为Cu+Hg2+═Cu2++Hg |
12.25℃时某0.1mol/L的一元弱酸(用HA表示),未电离的弱酸分子(HA)的物质的量与电离生成的阴、阳离子总物质的量之比为4.5:1,则此溶液( )
| A. | 电离度α为10% | B. | α=20% | ||
| C. | pH=1 | D. | c(OH-)=1×10-12mol/L |
2.25℃时某溶液中OH-的浓度是H+浓度的10000倍,该溶液的pH为( )
| A. | 5 | B. | 8 | C. | 9 | D. | 13 |
9.对于有气体参加的化学反应,下列说法正确的是( )
| A. | 增大压强,活化分子百分数增大,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率一定增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
9. 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
回答下列问题:
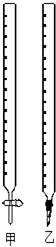
(1)如图中甲为酸式滴定管,乙为碱式 滴定管(填“酸式”或“碱式”)
(2)实验中,需要润洗的仪器是:(酸、碱式)滴定管
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂.滴定终点的判断依据是红色褪去,半分钟不再出现红色
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果偏高
(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果偏低.
(5)未知浓度的NaOH溶液的物质的量浓度为0.1288 mol/l.
 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
(1)如图中甲为酸式滴定管,乙为碱式 滴定管(填“酸式”或“碱式”)
(2)实验中,需要润洗的仪器是:(酸、碱式)滴定管
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂.滴定终点的判断依据是红色褪去,半分钟不再出现红色
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果偏高
(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果偏低.
(5)未知浓度的NaOH溶液的物质的量浓度为0.1288 mol/l.
10.已知同周期的X、Y、Z三种元素的最高价氧化物的水化物,其酸性由强到弱的顺序为 HZO4>H2YO4>H3XO4,判断下列叙述正确的是( )
| A. | 原子半径按X、Y、Z的顺序增大 | |
| B. | 单质的氧化性按X、Y、Z的顺序减弱 | |
| C. | 元素的非金属性按X、Y、Z的顺序增强 | |
| D. | 气态氢化物稳定性按X、Y、Z的顺序减弱 |