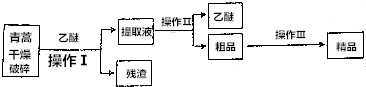
题目内容
12.下列各组物质按氧化物、酸、碱、盐的顺序排列正确的是( )| A. | MgO、H2SO4、Na2O、CaCl2 | B. | MnO2、HNO3、KOH、K2CO3 | ||
| C. | SO2、NaHSO4、Ca(OH)2、KCl | D. | CH3OH、CH3COOH、C2H5OH、CH4 |
分析 由两种元素组成其中一种是氧元素的化合物叫氧化物;电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,由金属离子和酸根离子组成的化合物是盐,根据以上概念分析.
解答 解:A.Na2O属于氧化物,不是碱,故A错误;
B.MnO2、HNO3、KOH、K2CO3分别属于氧化物、酸、碱、盐,故B正确;
C.NaHSO4属于盐,不属于酸,故C错误;
D.CH3OH含有3种元素,不属于氧化物,C2H5OH不属于碱、CH4不属于盐,故D错误.
故选B.
点评 本题主要考查物质的分类,解答时要分析物质的阴阳离子组成,然后再根据酸碱盐概念方面进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
相关题目
2.下列关于官能团的叙述不正确的是( )
| A. | 官能团能决定有机物的特殊性质 | |
| B. | 官能团可以是原子,也可以是原子团 | |
| C. | 若某有机物含有多种官能团,那么该有机物就有多种特殊性质 | |
| D. | 官能团就是原子团 |
3.下列有关数据的比较,不正确的是( )
| A. | 元素的价电子数和所在族的族序数相等 | |
| B. | NaOH晶体中的阳离子和阴离子数目相等 | |
| C. | CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 | |
| D. | [Co(NH3)6]3+中的NH3分子数与配位键数相等 |
20.现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
| A. | 将样品配制成溶液V1L,取其中25.00mL恰好与V2mL浓度为cmol/L酸性KMnO4溶液完全反应 | |
| B. | 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg | |
| C. | 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g | |
| D. | 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g |
7.下列叙述正确的是( )
| A. | S2-的结构示意图是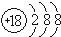 | B. | HCl 的电子式为H+[:Cl:]- | ||
| C. | H2O的结构式为H-O-H | D. | 还原性:HCl>H2S |
17.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图.下列有关该物质的说法正确的是( )
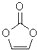

| A. | 1mol该物质最多可与2molH2加成 | B. | 分子式为C3H2O3 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |
4.在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)?C(g)+D(g)当下列物理量不再变化时,不能表明反应已达平衡的是( )
| A. | 混合气体的物质的量 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | 固体A的质量 |
2.25℃时某溶液中OH-的浓度是H+浓度的10000倍,该溶液的pH为( )
| A. | 5 | B. | 8 | C. | 9 | D. | 13 |