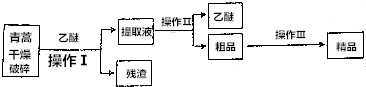
题目内容
14. 四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
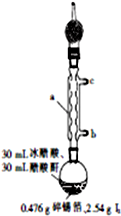
四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:步骤1:在150mL干燥的圆底烧瓶中,加入0.476g碎锡箔和2.54gI2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O].实验装置如图所示,组装好后用煤气灯加热至沸腾约1~1.5h,至反应完成;
步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到SnI4晶体1.881g.
回答下列问题:
(1)图中仪器a的名称为球形冷凝管;冷却水从接口b(填“b”或“c”)进入.
(2)仪器a上连接装有无水CaCl2的干燥管的目的是防止空气中水蒸气进入反应器中;锡箔需剪碎的目的是增大与I2的接触面,加快反应速率;加入醋酸酐的目的是除去体系中的水,防止四碘化锡水解.
(3)烧瓶中发生反应的化学方程式为Sn+2I2$\frac{\underline{\;\;△\;\;}}{\;}$SnI4;单质碘需过量的主要目的是使锡反应完全,防止锡屑混入四碘化锡晶体中.
(4)反应已到终点的现象是紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色.
(5)步骤3和步骤4的目的是提纯SnI4产品;该次合成的产率为75%.
分析 (1)由仪器a的结构可知为球形冷凝管,采取逆流原理通入冷凝水,充满整个冷凝管,充分冷凝;
(2)四碘化锡遇水易水解,装有无水CaCl2的干燥管可吸收空气中的水蒸气;锡箔需剪碎增大与I2的接触面;醋酸酐能与水反应;
(3)锡与碘反应生成四碘化锡,单质碘过量可使锡反应完全;
(4)碘蒸气为紫红色,反应结束时紫色消失;
(5)醋酸易溶于氯仿,除掉杂质,提纯SnI4产品,根据Sn计算生成SnI4的理论质量,产率=$\frac{实际质量}{理论产率}$×100%.
解答 解:(1)仪器a的名称为球形冷凝管,冷凝水下进上出,使冷凝水充满整个冷凝管,充分冷凝,
故答案为:球形冷凝管;b;
(2)四碘化锡遇水易水解,装有无水CaCl2的干燥管可吸收空气中的水蒸气,防止空气中水蒸气进入反应器中,导致四碘化锡水解,锡箔需剪碎增大与I2的接触面,加快反应速率;醋酸酐能与水反应,防止四碘化锡水解,
故答案为:防止空气中水蒸气进入反应器中;增大与I2的接触面,加快反应速率;除去体系中的水,防止四碘化锡水解;
(3)锡与碘反应生成四碘化锡,Sn+2I2$\frac{\underline{\;\;△\;\;}}{\;}$SnI4,单质碘过量可使锡反应完全,防止锡屑混入四碘化锡晶体中,
故答案为:Sn+2I2$\frac{\underline{\;\;△\;\;}}{\;}$SnI4;使锡反应完全,防止锡屑混入四碘化锡晶体中;
(4)紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色,说明反应到达终点,
故答案为:紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色;
(5)醋酸易溶于氯仿,除掉杂质,提纯SnI4产品,
生成SnI4的理论质量为$\frac{0.476g}{119g/mol}$×(119+127×4)=2.508g,则产率=$\frac{1.881g}{2.508g}$×100%=75%,
故答案为:提纯SnI4产品;75%.
点评 本题考查物质的制备实验,涉及物质的分离提纯、化学仪器识别、对操作与原理的分析评价、产率计算等,注意对题目信息运用,是对学生综合能力的考查.

| A. | 5 | B. | 8 | C. | 9 | D. | 13 |
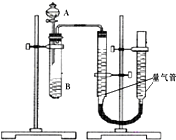 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(2)分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/ml | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4溶液过量.
 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
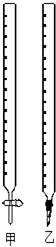
(1)如图中甲为酸式滴定管,乙为碱式 滴定管(填“酸式”或“碱式”)
(2)实验中,需要润洗的仪器是:(酸、碱式)滴定管
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂.滴定终点的判断依据是红色褪去,半分钟不再出现红色
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果偏高
(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果偏低.
(5)未知浓度的NaOH溶液的物质的量浓度为0.1288 mol/l.
| A. | O2和O3 | B. | 2H2和3H2 | ||
| C. | H2O与H2O2 | D. | C2H5COOH与CH3COOCH3 |
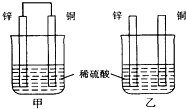
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |
 ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
| A. | 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 | |
| B. | 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 | |
| C. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| D. | 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |