题目内容
13.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )| A. | SO2和C(金刚石) | B. | CO2和H2 | C. | NaCl和HCl | D. | MgCl2和KCl |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子晶体,共价键可存在于原子晶体或分子晶体,结合晶体的构成微粒来解答.
解答 解:A.均只含共价键,但SO2和C(金刚石)分别为分子晶体、原子晶体,故A不选;
B.均由分子构成,则均为分子晶体,均只含共价键,但分别为极性共价键、非极性共价键,故B不选;
C.分别含离子键和共价键,分别为离子晶体、分子晶体,故C不选;
D.均只含离子键,均为离子晶体,故D选;
故选D.
点评 本题考查化学键及晶体类型,为高频考点,把握化学键的形成及判断的一般规律、晶体类型判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.下列有关数据的比较,不正确的是( )
| A. | 元素的价电子数和所在族的族序数相等 | |
| B. | NaOH晶体中的阳离子和阴离子数目相等 | |
| C. | CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 | |
| D. | [Co(NH3)6]3+中的NH3分子数与配位键数相等 |
4.在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)?C(g)+D(g)当下列物理量不再变化时,不能表明反应已达平衡的是( )
| A. | 混合气体的物质的量 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | 固体A的质量 |
18.下列说法错误的是( )
| A. | 常温下,0.1mol•L-1的CH3COOH溶液中,由水电离出的c(H+)为1.0×10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液的pH<7 | |
| D. | 25℃时,完全中和50mLpH=3的H2SO4溶液,需要pH=11的NaOH溶液50mL |
5.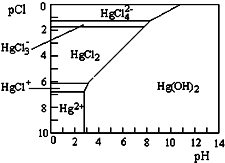 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )| A. | 正常海水(Cl-的浓度大于0.1mol•L-1)中汞元素的主要存在形态是HgCl42- | |
| B. | 少量Hg(NO3)2溶于0.001mol•L-1的盐酸后,汞元素的主要存在形态是HgCl2 | |
| C. | 将Hg(NO3)2固体直接溶于水中配制溶液 | |
| D. | 可用废铜屑处理含Hg2+的废水,其离子方程式为Cu+Hg2+═Cu2++Hg |
2.25℃时某溶液中OH-的浓度是H+浓度的10000倍,该溶液的pH为( )
| A. | 5 | B. | 8 | C. | 9 | D. | 13 |
6.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
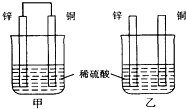

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |