题目内容
8.下列关于混合物、强电解质、弱电解质和非电解质的组合正确的是( )| 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 氨水 | H2SO4 | CH3COOH | 干冰 |
| B | 盐酸 | 氢氧化钠 | H2SO4 | SO2 |
| C | 纯碱 | BaSO4 | H2S | 空气 |
| D | 氢氧化钠溶液 | 石灰石 | 熔融NaCl | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
分析 纯净物:有一种物质组成,包括单质和化合物,
混合物:由两种或两种以上的物质组成,
在水溶液里或熔融状态下完全电离的是强电解质,部分电离的是弱电解质,
在水溶液里或熔融状态下不导电的化合物是非电解质,电解质和非电解质都是化合物来分析.
解答 解:A.氨水是氨气的水溶液为混合物,硫酸是强电解质,醋酸为弱酸属于弱电解质,干冰是二氧化碳不能电离属于非电解质,故A正确;
B.盐酸是氯化氢气体的水溶液属于混合物,氢氧化钠是强碱属于强电解质,硫酸是强酸属于强电解质,二氧化硫不能电离属于非电解质,故B错误;
C.纯碱是碳酸钠俗称为纯净物,硫酸钡熔融状态完全电离属于强电解质,硫化氢是弱酸属于弱电解质,空气是混合物不是电解质或非电解质,故C错误;
D.氢氧化钠溶液属于混合物,石灰石主要成分为碳酸钙属于混合物不是电解质,熔融氯化钠完全电离属于强电解质,氯气是单质不是非电解质或电解质,故D错误;
故选A.
点评 本题考查了纯净物、混合物、电解质、非电解质的概念判断,熟悉相关概念是解题关键,注意电解质、非电解质都是化合物,题目难度不大.

练习册系列答案
相关题目
19.改变反应物用量,下列反应能用同一个反应方程式表示的是( )
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥NH3与O2的反应.
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥NH3与O2的反应.
| A. | ②⑤⑥ | B. | ①②③⑤ | C. | ①③④⑥ | D. | ①③④⑤⑥ |
3.一定温度下,在恒容的密闭容器中,能表示反应:N2(g)+3H2(g)?2NH3(g)达到平衡状态的标志有( )
①容器中的压强不再发生变化
②H2的生成速率与NH3的消耗速率之比为3:2
③混合气的平均相对分子质量不变
④容器内混合气的密度不变
⑤NH3的物质的量浓度不再变化
⑥密闭容器中n(N2):n(H2):n(NH3)=1:3:2.
①容器中的压强不再发生变化
②H2的生成速率与NH3的消耗速率之比为3:2
③混合气的平均相对分子质量不变
④容器内混合气的密度不变
⑤NH3的物质的量浓度不再变化
⑥密闭容器中n(N2):n(H2):n(NH3)=1:3:2.
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③⑤ | D. | ②④⑥ |
13.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到金属的单质 | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能生成H+的化合物是酸 |
20.下列化合物不能由单质和Cl2直接化合制得的是( )
| A. | MgCl2 | B. | CuCl2 | C. | FeCl2 | D. | HCl |
18.由A、B、C、D四种金属按表中装置图进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是D>A>B>C.
(5)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
| 装置 | 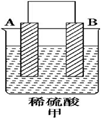 |  | 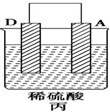 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是D>A>B>C.
(5)A、C形成合金,露置在潮湿空气中,A先被腐蚀.

 .
. .
. .
.