题目内容
3.有8种物质:①甲烷;②苯;③聚乙烯;④2-丁炔;⑤乙醇;⑥邻二甲苯;⑦环己烯;⑧乙醛.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )| A. | ③④⑤⑧ | B. | ④⑤⑧ | C. | ③④⑤⑦⑧ | D. | ④⑦⑧ |
分析 含碳碳双键、三键、-CHO的有机物既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,以此来解答.
解答 解:①甲烷与高锰酸钾、溴水均不反应,故不选;
②苯与高锰酸钾、溴水均不反应,故不选;
③聚乙烯不含碳碳双键,与高锰酸钾、溴水均不反应,故不选;
④2-丁炔中含碳碳三键,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
⑤乙醇与溴水不反应,故不选;
⑥邻二甲苯与溴水不反应,故不选;
⑦环己烯中含碳碳双键,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
⑧乙醛中含-CHO,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.

练习册系列答案
相关题目
13.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到金属的单质 | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能生成H+的化合物是酸 |
14.亚硝酸钠又称为“工业盐”,在新闻报道中常出现因误食工业盐而导致中毒的事件,下列关于亚硝酸钠的叙述不正确的是( )
| A. | 亚硝酸钠外观与食盐相似 | |
| B. | 亚硝酸钠和食盐一样也具有咸味 | |
| C. | 食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂 | |
| D. | 亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀 |
18.由A、B、C、D四种金属按表中装置图进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是D>A>B>C.
(5)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
| 装置 | 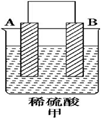 |  | 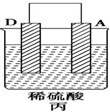 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是D>A>B>C.
(5)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
8.已知反应:5NH4NO3$\stackrel{△}{→}$4N2↑+2HNO3+9H2O,其中被氧化的氮原子与被还原的氮原子个数之比是( )
| A. | 1:1 | B. | 5:3 | C. | 3:5 | D. | 2:1 |
15.下列反应的离子方程式书写不正确的是( )
| A. | 镁条与稀盐酸反应:Mg+2H+═H2↑+Mg 2+ | |
| B. | 铝丝与硫酸铜溶液反应:Al+Cu 2+═Al 3++Cu | |
| C. | 铜丝与硝酸银溶液反应:Cu+2Ag+═2Ag+Cu 2+ | |
| D. | 锌和氯化铜溶液反应:Zn+Cu2+═Zn 2++Cu |
10.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | X、Y、Z三种元素的单质中,Z单质的氧化性最强 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2、CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
 向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7.
向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7. .
.