题目内容
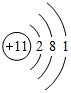
11.甲,乙,丙,丁,戊是五种短周期元素,甲是短周期中金属性最强的元素:乙原子中,K层与M层电子数相等;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子电荷数多2;戊的原子半径是短周期主族元素中最小的,请回答:(1)元素甲的原子结构示意图
 .
.(2)甲和乙的最高价氧化物的水化物中,碱性较强的是NaOH(填相应物质的化学式).
(3)单质甲能与丁,戊两种元素形成的10电子的液态化台物反应,写出相关反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
(4)丙、丁两种元素能以原子个数比1:2组成化合物A,A的结构式为O=C=O;单质乙能与化合物A反应,写出相关反应的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO.
分析 甲,乙,丙,丁,戊是五种短周期元素,甲是短周期中金属性最强的元素,则甲为Na元素;乙原子中,K层与M层电子数相等,则乙为Mg原子;丙原子的最外层电子数是次外层电子数的2倍,最外层最多容纳8个电子,则丙为C元素;丁原子核电荷数比丙原子电荷数多2,则丁为O元素;戊的原子半径是短周期主族元素中最小的,则戊为H元素,据此结合元素周期律知识解答.
解答 解:甲,乙,丙,丁,戊是五种短周期元素,甲是短周期中金属性最强的元素,则甲为Na元素;乙原子中,K层与M层电子数相等,则乙为Mg原子;丙原子的最外层电子数是次外层电子数的2倍,最外层最多容纳8个电子,则丙为C元素;丁原子核电荷数比丙原子电荷数多2,则丁为O元素;戊的原子半径是短周期主族元素中最小的,则戊为H元素,
(1)元素甲而Na元素,钠原子的核电荷数为11,核外电子总数为11,其原子结构示意图为: ,
,
故答案为: ;
;
(2)甲和乙分别为N、Mg元素,金属性越强,最高价氧化物对应水合物的碱性越强,金属性Na>Mg,则最高价氧化物的水化物中,碱性较强的是NaOH,
故答案为:NaOH;
(3)丁、戊两种元素形成的10电子的液态化合物为水,甲的单质为金属Na,钠与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(4)丙为C元素,丁为O元素,丙、丁两种元素能以原子个数比1:2组成化合物A为二氧化碳,二氧化碳为直线型结构,其结构式为:O=C=O;
单质乙为金属Mg,Mg能与二氧化碳反应生成氧化镁和C,反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,
故答案为:O=C=O;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意注意熟练掌握原子结构与元素周期律的关系,试题培养了学生的分析能力及逻辑推理能力.

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案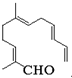 从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )
从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )| A. | 可发生1,4-加成 | |
| B. | 与新制的Cu(OH)2悬浊液反应后得到饱和羧酸 | |
| C. | 1mol该有机物最多与含5molBr2的溴水发生加成 | |
| D. | 与H2反应时一定可得到饱和一元醇 |
| A. | $\frac{49ωA(100-C)}{3000B}$g | B. | $\frac{40ω•C%}{30}$g | C. | $\frac{49ωA(1-C%)}{30B}$g | D. | $\frac{30ωA•C%}{49B}$g |
| A. | Na2SiO3溶液 | B. | HF溶液 | C. | NaNO3溶液 | D. | NaCl溶液 |
| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) | |
| D. | c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
①纯碱的分子式为:NaHCO3 ②HCl的电子式:

③氟离子的结构示意图:
 ④过氧化氢的结构式:H-O-O-H
④过氧化氢的结构式:H-O-O-H⑤苯的最简式:C6H6 ⑥乙烯的结构简式:CH2=CH2.
| A. | ①②④⑥ | B. | ③④⑥ | C. | ①④⑥ | D. | ④⑥ |
| A. | 所有的醇都能与水以任意比互溶 | |
| B. | 醇和酚具有相同的官能团--羟基(-OH),因而具有相同的化学性质 | |
| C. | 相对分子质量相近的醇和烷烃相比,醇的沸点低于烷烃的沸点 | |
| D. | 苯酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性 |

 化学能帮助我们更好地认识生活、改善生活.
化学能帮助我们更好地认识生活、改善生活. )易分解为乙酸和氧气,其稀溶常用于餐具器械的消毒.过氧乙酸分解的化学方程式2C2H4O3$\frac{\underline{\;\;△\;\;}}{\;}$2C2H4O2+O2↑.某胃药的主要成分是AlbMgc(OH)mCO3,常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式2AlbMgc(OH)mCO3+(6b+4c)HCl=2bAlCl3+2cMgCl2+(3b+2c+m)H2O+2CO2↑.
)易分解为乙酸和氧气,其稀溶常用于餐具器械的消毒.过氧乙酸分解的化学方程式2C2H4O3$\frac{\underline{\;\;△\;\;}}{\;}$2C2H4O2+O2↑.某胃药的主要成分是AlbMgc(OH)mCO3,常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式2AlbMgc(OH)mCO3+(6b+4c)HCl=2bAlCl3+2cMgCl2+(3b+2c+m)H2O+2CO2↑.