题目内容
20.如图1所示:向饱和Ba(OH)2溶液中逐滴加入稀硫酸,不断搅拌至过量.(1)主要的实验现象:烧杯中有白色沉淀生成,灯泡逐渐变暗直至熄灭,后逐渐变亮.
(2)烧杯中反应的离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O.

(3)图2所示能正确表示实验过程的是abc(填序号).
分析 (1)向Ba(OH)2溶液中逐滴加入稀硫酸,离子方程式为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,随反应的进行溶液中自由移动的离子浓度减小;
(2)反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(3)随反应的进行导电能力先减弱后增强;随硫酸的加入沉淀质量逐渐增加,后不变;随硫酸的加入溶液由碱性到中性,最后变酸性;随硫酸的加入硫酸根离子的浓度先减小,后变大.
解答 解:(1)向Ba(OH)2溶液中逐滴加入稀硫酸,离子方程式为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,随反应的进行溶液中自由移动的离子浓度减小,当两者恰好完全反应时离子的浓度为0,然后再滴加入稀硫酸,导电能力增强,所以主要的实验现象:有白色沉淀生成,逐渐变暗直至熄灭,后逐渐变亮,故答案为:有白色沉淀生成;逐渐变暗直至熄灭,后逐渐变亮;
(2)氢氧化钡与稀硫酸反应生成硫酸钡和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(3)随反应的进行导电能力先减弱后增强;随硫酸的加入沉淀质量逐渐增加,后不变;随硫酸的加入溶液由碱性到中性,最后变酸性;随硫酸的加入硫酸根离子的浓度先减小,后变大;所以正确表示实验过程的是abc,故答案为:abc.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质及离子浓度与导电性关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.有关热稳定性强弱的比较,不正确的是( )
| A. | KClO3<KCl | B. | K2MnO4>KMnO4 | C. | NaHCO3>Na2CO3 | D. | CaCO3<CaO |
8.将含有氧化铁的铁片投入足量稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与生成的H2的物质的量之比为2:1,则原混合物中Fe2O3与铁的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:4 | D. | 3:1 |
15.图为锌一铜原电池示意图,下列说法错误的是( )
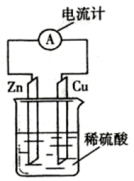

| A. | 电子由铜片通过导线流向锌片 | |
| B. | 锌片为负极,且锌片逐渐浓解 | |
| C. | 铜为正极,铜不易失电了而受到保护 | |
| D. | 该装置能将化学能抟变为电能 |
5.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol碳正离子(CH3+)所含质子总数为8NA | |
| B. | 常温常压下,46gNO2和N2O4混和气体中含原子总数为3NA | |
| C. | 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA | |
| D. | 14g14C原子形成的石墨中,所含C-C健的个数为NA |
12.下列选项中不能说明硫元素的非金属性强于碳元素的是( )
| A. | 硫酸酸性强于碳酸 | |
| B. | 硫与氢气加热到500℃生成H2S,碳与氢气隔绝空气加热到1200℃生成CH4 | |
| C. | CS2中硫显示-2价 | |
| D. | 硫位于ⅥA族,碳位于ⅣA族 |
12.某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化(结果如图2).下列叙述错误的是( )


| A. | 图2中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀 | |
| B. | 碳粉表面的电极反应式只有:2H2O+O2+4e-═4OH- | |
| C. | 碳粉表面一定发生了还原反应 | |
| D. | 图3中,发生腐蚀时电子转移方向如箭头所示 |
13.下列物质中,属于有机高分子材料的是( )
| A. | 不锈钢 | B. | 水泥 | C. | 橡胶 | D. | 陶瓷 |
 .
.