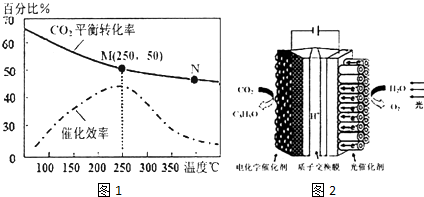
题目内容
19.已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:(1)两溶液中c(H+)•c(OH-)=1×10-14.
(2)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是H2SO4溶液.
(3)各取5mL上述溶液,分别加热到90℃,pH较小的是NH4Cl溶液.
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液1×10-9mol/L;NH4Cl溶液1×10-5mol/L.
(5)取5mL NH4Cl溶液,加水稀释至50mL,$\frac{c(N{H}_{4}^{+})}{c({H}^{+})}$减小(填“增大”、“减小”或“不变”).
(6)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10-8mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).若在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0.2mol•L-1.
分析 (1)室温下水的离子积为1×10-14;
(2)强酸溶液稀释,氢离子浓度随体积变化减小,氯化铵溶液稀释除随体积变化浓度减小外,稀释促进铵根离子的水解,氢离子浓度增大;
(3)氯化铵水解过程是吸热反应,加热溶液,促进水解氢离子浓度变大,硫酸溶液加热,氢离子浓度基本不变;
(4)硫酸中的氢氧根离子是水电离的,氯化铵溶液中的氢离子是水电离的,据此进行计算;
(5)氯化铵溶液稀释促进水解平衡正向进行;
(6)pH=8时,c(OH-)=1×10-6mol/L,c(Cu2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$;若在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸.
解答 解:(1)室温下两溶液中水的离子积Kw=c(H+)•c(OH-)=1×10-14,
故答案为:1×10-14;
(2)室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加水稀释至50mL,稀释10倍,硫酸溶液PH变化为6,氯化铵铵根离子水解促进,溶液中氢离子浓度减小的少,溶液pH小于6;pH较大的是硫酸溶液;
故答案为:H2SO4;
(3)室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加热到90℃,硫酸溶液中氢离子浓度变化不大,氯化铵溶液中水解是吸热反应,加热促进水解,氢离子浓度增大,溶液pH较小的是氯化铵溶液,
故答案为:NH4Cl;
(4)室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液中存在离子积常数,硫酸溶液中,c(H+)酸×c(OH-)水=10-14,则水电离的氢氧根离子的浓度c(OH-)水=1×10-9mol/L;氯化铵溶液中,c(H+)水×c(OH-)水剩余=10-14,则水电离的氢离子浓度为c(H+)水=1×10-5mol/L,
故答案为:1×10-9mol/L;1×10-5mol/L;
(5)取5mL NH4Cl溶液,加水稀释至50mL,铵根离子水解平衡NH4++H2O?NH3•H2O+H+正向移动,溶液中的铵根离子减小,氢离子增多,$\frac{c(N{H}_{4}^{+})}{c({H}^{+})}$ 离子浓度比值减小,
故答案为:减小;
(6)pH=8时,c(OH-)=10-6mol/L,Ksp[Cu(OH)2]=2.2×10-20,则:c(Cu2+)=$\frac{2.20×1{0}^{-20}}{(1×1{0}^{-6})^{2}}$=2.2×10-8mol•L-1;在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1mol•L-1,由电荷守恒可知c(H+)为0.2mol•L-1,
故答案为:2.2×10-8;0.2.
点评 本题考查酸碱混合及难溶电解质的溶解平衡,为高频考点,把握离子浓度、Kw、pH计算及Ksp计算为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.

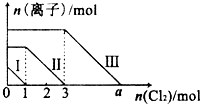 向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 原混合溶液中n(FeBr2)=4mol | ||
| C. | 线段Ⅰ代表Br-的变化情况 | D. | a值等于6 |
| A. | Ba(OH)2与NaHSO4 | B. | Ba(OH)2与H2SO4 | ||
| C. | 石灰水和二氧化碳 | D. | Ca(HCO3)2与NaOH |
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
(2)Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-?Ag2S(s)+2Cl-,沉淀转化的主要原因是Ag2S比AgCl溶解度更小.
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y.
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是SO42-.
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀S.
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化.
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
②C中盛放的物质W是Ag2S的悬浊液.
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S+1O2++4NaCl+2H2O?4AgCl+2S+4NaOH.
 25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )
25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )| A. | 曲线a表示PbCO3 | |
| B. | 以PbSO4、Na2CO3和焦炭为原料可制备Pb | |
| C. | 当PbSO4和PbCO3沉淀共存时,溶液中$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=105 | |
| D. | 向X点对应的饱和溶液中加入少量Pb(NO3)2,可转化为Y点对应的溶液 |