题目内容
15.下列说法不正确的是( )| A. | 钠、铁和铜一样都能在氯气中燃烧生成金属氯化物 | |
| B. | 硫酸铜溶液中加入足量铝粉,充分振荡溶液颜色将由蓝色变成无色,同时有红色物质析出 | |
| C. | 实现SO2→S的变化需要氧化剂才能实现 | |
| D. | 氯水具有杀菌、漂白作用是因氯水中含有强氧化性的次氯酸 |
分析 A.氯气性质活泼,能与金属反应生成高价氯化物;
B.铝的活泼性强于铜;
C.SO2→S硫元素化合价降低,应加入还原剂;
D.次氯酸具有强的氧化性,能使蛋白质变性.
解答 解:A.钠、铁和铜一样都能在氯气中燃烧分别生成氯化钠、氯化铁和氯化铜,故A正确;
B.铝的活泼性强于铜,硫酸铜溶液中加入足量铝粉,能够置换出铜,所以充分振荡溶液颜色将由蓝色变成无色,同时有红色物质析出,故B正确;
C.SO2→S硫元素化合价降低,应加入还原剂,故C错误;
D.氯水具有杀菌、漂白作用是因氯水中含有强氧化性的次氯酸,次氯酸能够使蛋白质变性,故D正确;
故选:C.
点评 本题考查了物质的性质,明确氯气、次氯酸等性质是解题关键,注意氧化还原反应基本概念的掌握,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器.研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义.下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是( )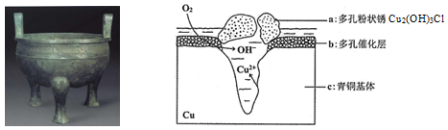

| A. | 青铜器发生电化学腐蚀,图中c作负极,被氧化 | |
| B. | 正极发生的电极反应为O2+4e-+2H2O=4OH- | |
| C. | 环境中的Cl-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| D. | 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L |
3.一些常见有机物的转化如图下列说法正确的是( )


| A. | 上述有机物中只有C6H12O6属于糖类物质 | |
| B. | 转化1可在人体内完成,该催化剂属于蛋白质 | |
| C. | 物质C和油脂类物质互为同系物 | |
| D. | 物质A和B都属于电解质 |
10.浓硫酸的危险警告标签是( )
| A. |  | B. |  | C. |  | D. |  |
20.下列溶液中,与100ml 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L HCl溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L CaCl2溶液 |
7.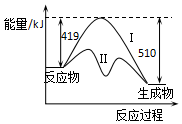 已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
 已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )| A. | 加入催化剂,△H变小 | |
| B. | △H=+91 kJ/mol | |
| C. | 生成1molCH3OH(l)时,△H值增大 | |
| D. | 反应物的总能量大于生成物的总能量 |
4.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
5.某有机化合物D的结构为  ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )| A. | 烃A为乙烯 | |
| B. | 反应①、②、③的反应类型依次为加成反应,取代反应,取代反应 | |
| C. | 反应③为了加快反应速率可以快速升温至170℃度 | |
| D. | 化合物D属于醚 |