题目内容
某2.0L硫酸溶液中含有1.0molH2SO4.试计算:
(1)溶液中的物质的量浓度.
(2)向上述溶液中加入足量的铁粉,产生的气体的体积(标况).
(1)溶液中的物质的量浓度.
(2)向上述溶液中加入足量的铁粉,产生的气体的体积(标况).
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:计算题
分析:(1)根据c=
计算该硫酸溶液的物质的量浓度;
(2)加入足量的Fe粉,硫酸完全反应,根据方程式Fe+H2SO4=FeSO4+H2↑计算生成氢气的体积.
| n |
| V |
(2)加入足量的Fe粉,硫酸完全反应,根据方程式Fe+H2SO4=FeSO4+H2↑计算生成氢气的体积.
解答:
解:(1)2.0L硫酸溶液中含有1.0molH2SO4,硫酸溶液的物质的量浓度=
=0.5mol/L,
答:该酸溶液的物质的量浓度为0.5mol/L;
(2)加入足量的Fe粉,1.0mol硫酸完全反应,设生成氢气的体积为V,则:
Fe+H2SO4=FeSO4+H2↑
1mol 22.4L
1.0mol V
故V=22.4L×
=22.4L,
答:生成氢气的体积为22.4L.
| 1.0mol |
| 2.0L |
答:该酸溶液的物质的量浓度为0.5mol/L;
(2)加入足量的Fe粉,1.0mol硫酸完全反应,设生成氢气的体积为V,则:
Fe+H2SO4=FeSO4+H2↑
1mol 22.4L
1.0mol V
故V=22.4L×
| 1.0mol |
| 1mol |
答:生成氢气的体积为22.4L.
点评:本题考查物质的量浓度计算、根据方程式进行的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确根据方程式计算的方法.

练习册系列答案
相关题目
NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,44 g C3H8中含有的碳碳单键数为3NA |
| B、1mol羟基中电子数为10NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D、标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1L 1.0mol/L Na2SO4溶液中离子的总数为2NA |
| B、在标准状况下,NA个CCl4分子所占的体积为22.4L |
| C、0.5mol Mg2+的最外电子总数4NA |
| D、常温常压下,11.2L氨气含有的质量为8.5g |
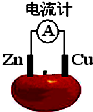 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.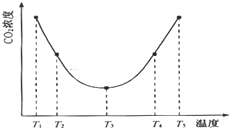 能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.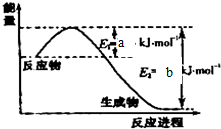 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答: