题目内容
 能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)“原子经济性”强调在化学品合成过程中,应尽可能把原材料都转化为目标产物.工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济性”原则的是
②反应Ⅱ的平衡常数表达式是
③下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
④某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,则CO的转化率为
(2)燃料燃烧会产生温室气体,捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前(NH4)2CO3已经被用作工业捕碳剂,它与CO2可发生如下可逆反应:
(NH4)2CO3(aq)+H2O(l)+CO2(g)?2(NH4)2HCO3(aq)△H<0
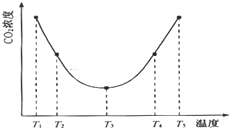
为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图).则:
①在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图所示的变化趋势,其原因是
②利用该原理捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
③下列物质中也可能作为CO2捕获剂的是
A.NH4ClB.Na2CO3 C.CH3OH D.NH3.
考点:化学平衡常数的含义,化学平衡的计算
专题:化学平衡专题
分析:(1)①“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
②依据化学方程式和平衡常数概念书写表达式;
③依据图表数据分析,平衡常数随温度升高减小,平衡逆向进行,逆反应为吸热反应,该反应为放热反应;
④根据一氧化碳的平衡浓度计算平衡时一氧化碳的物质的量,再根据转化率公式计算其转化率;
(2)①温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H3<0),T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获
反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡;
②根据平衡移动原理分析;
③具有碱性的物质均能捕获CO2.
②依据化学方程式和平衡常数概念书写表达式;
③依据图表数据分析,平衡常数随温度升高减小,平衡逆向进行,逆反应为吸热反应,该反应为放热反应;
④根据一氧化碳的平衡浓度计算平衡时一氧化碳的物质的量,再根据转化率公式计算其转化率;
(2)①温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H3<0),T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获
反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡;
②根据平衡移动原理分析;
③具有碱性的物质均能捕获CO2.
解答:
解:(1)①根据原子经济知,Ⅰ没有副产物,符合原子经济理念,Ⅱ中有副产物,不符合原子经济理念;
故答案为:Ⅰ;
②反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应的平衡常数K=
;
故答案为:
;
③根据图象知,反应物总能量大于生成物总能量,所以该反应是放热反应,则△H1<0,故答案为:<;
④平衡时剩余一氧化碳的物质的量=0.2mol/L×2L=0.4mol,一氧化碳的转化率=
×100%=80%,故答案为:80%;
(2)①由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H3<0,在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小,T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高,T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获;
故答案为:T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高.T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获;
②根据平衡移动原理,降低温度或增大c(CO2),故答案为:降低温度,增大CO2浓度;
③具有碱性的物质均能捕获CO2,反应如下:Na2CO3+CO2+H2O=2NaHCO3;HOCH2CH2NH2+CO2+H2O=HOCH2CH2NH3++HCO3-,故答案为:B、D.
故答案为:Ⅰ;
②反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应的平衡常数K=
| c(H2O)c(CH3OH) |
| c(CO2)c3(H2) |
故答案为:
| c(H2O)c(CH3OH) |
| c(CO2)c3(H2) |
③根据图象知,反应物总能量大于生成物总能量,所以该反应是放热反应,则△H1<0,故答案为:<;
④平衡时剩余一氧化碳的物质的量=0.2mol/L×2L=0.4mol,一氧化碳的转化率=
| (2-0.4)mol |
| 2mol |
(2)①由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H3<0,在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小,T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高,T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获;
故答案为:T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高.T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获;
②根据平衡移动原理,降低温度或增大c(CO2),故答案为:降低温度,增大CO2浓度;
③具有碱性的物质均能捕获CO2,反应如下:Na2CO3+CO2+H2O=2NaHCO3;HOCH2CH2NH2+CO2+H2O=HOCH2CH2NH3++HCO3-,故答案为:B、D.
点评:本题考查“原子经济性”概念的理解、化学平衡常数、化学平衡计算、反应中能量的变化等,熟练掌握基础是关键,难度较大.

练习册系列答案
相关题目
 如图各装置不能达到实验目的是( )
如图各装置不能达到实验目的是( )| A、装置①可制取少量蒸馏水 |
| B、装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C、装置③可用于排空气法收集NO气体 |
| D、装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
下列关于胶体的叙述中正确的是( )
| A、液溶胶是一种液态混合物属于分散系的一种 |
| B、直径介于1 nm~10 nm之间的微粒称为胶体 |
| C、胶体的本质特征是发生丁达尔效应 |
| D、用过滤器可以将胶体和溶液分开 |
若胃酸酸度增高就会患胃酸过多症,下列物不宜用做治疗胃酸过多的药物是 ( )
| A、小苏打粉 | B、氢氧化铝粉 |
| C、氢氧化钠粉 | D、纯碳酸钙粉 |
 人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):