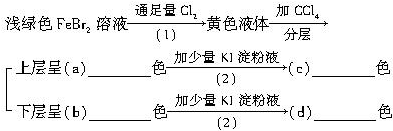
题目内容
17.为了除去CuCl2酸性溶液中的Fe3+,可在加热条件下加入一种试剂,该试剂是( )| A. | 氢氧化钠 | B. | 硫酸 | C. | 氧化铜 | D. | 氨水 |
分析 Fe3+易水解生成氢氧化铁沉淀,所加入物质起到调节溶液pH的作用,但不能引入新的杂质.
解答 解:加入氢氧化钠、氨水质,虽可起到调节溶液pH的作用,但引入新的杂质,不符合除杂的原则,铁离子与硫酸不反应;
Fe3+易水解生成氢氧化铁沉淀,可加入碳酸铜、氧化铜或氢氧化铜等物质,调节溶液的pH且不引入新的杂质,
故选C.
点评 本题考查盐类水解的原理及应用,为高频考点,侧重于除杂与分离,题目较为基础,解答本题的关键是能把握除杂的原则.

练习册系列答案
相关题目
18.下列有关物质转化的说法正确的是( )
| A. | 石油生产汽油的过程中没有发生化学变化 | |
| B. | 氮的固定过程中氮元素被氧化 | |
| C. | 葡糖糖转变成酒精的过程中产生的是水解反应 | |
| D. | 鸡蛋被煮熟的过程中发生的是蛋白质的变性 |
8.下列物质属于弱电解质的是( )
| A. | 硫酸钡 | B. | 蔗糖 | C. | 醋酸 | D. | 二氧化硫 |
5.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 常温下,100mL1mol/LNa2CO3溶液中阴离子总数大于0.1NA | |
| C. | 1L0.1mol/L醋酸溶液中含有H+数目为0.1NA | |
| D. | 将0.1mol氯化铁溶于水中配成1L溶液,所得溶液中含有的Fe3+数目为0.1NA |
2.在无色酸性溶液中能大量共存的离子组是( )
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Na+、Ca2+、Cl-、NO3- | D. | Ag+、Cu2+、CO32-、Cl- |
9.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 红磷在氯气中反应,1mol红磷失去的电子数一定为5NA | |
| B. | 标准状况下22.4L C3H8中含中子数为18NA | |
| C. | 1L 1mol/L的葡萄糖溶液中,含有的分子数为NA个 | |
| D. | 常温下78 g过氧化钠和122 g水混合,所得溶液质量分数为40% |
7.炼铝厂的废料中主要含Al、Al2O3及少量SiO2和FeO•xFe2O3,可用于制备明矾[KAl(SO4)2•12H2O].工艺流程如下:
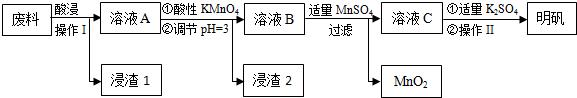
(1)“酸浸”过程中的应选择H2SO4(写酸的化学式).为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有提高反应温度、粉碎等.(写出两条)
(2)操作Ⅰ是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)在溶液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
调节pH=3的目的是使Fe3+转化成Fe(OH)3沉淀,防止Al3+沉淀.此步骤中,可以用H2O2代替KMnO4,写出H2O2的电子式 .
.
(4)只用一种试剂检验溶液A中是否存在Fe2+,该试剂是高锰酸钾酸性溶液或铁氰化钾溶液(写名称).
(5)己知在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+.

(1)“酸浸”过程中的应选择H2SO4(写酸的化学式).为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有提高反应温度、粉碎等.(写出两条)
(2)操作Ⅰ是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)在溶液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
 .
.(4)只用一种试剂检验溶液A中是否存在Fe2+,该试剂是高锰酸钾酸性溶液或铁氰化钾溶液(写名称).
(5)己知在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+.
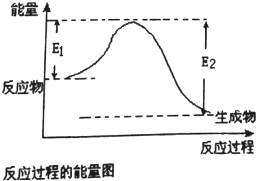 已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题:
已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题: ,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.
,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.