题目内容
16.下列离子方程式正确的是( )| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 足量二氧化碳通入NaOH溶液:CO2+OH-═HCO3- | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ |
分析 A.漏写氧化剂水;
B.反应生成碳酸氢钠;
C.反应生成的HClO在离子反应中保留化学式;
D.生成胶体,不是沉淀.
解答 解:A.金属铝溶于氢氧化钠溶液的离子反应为2H2O+2Al+2OH-═2AlO2-+3H2↑,故A错误;
B.足量二氧化碳通入NaOH溶液的离子反应为CO2+OH-═HCO3-,故B正确;
C.Cl2溶于水的离子反应为Cl2+H2O═H++Cl-+HClO,故C错误;
D.向沸水中滴加饱和的氯化铁溶液的离子反应为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及反应实质,题目难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
7.炼铝厂的废料中主要含Al、Al2O3及少量SiO2和FeO•xFe2O3,可用于制备明矾[KAl(SO4)2•12H2O].工艺流程如下:
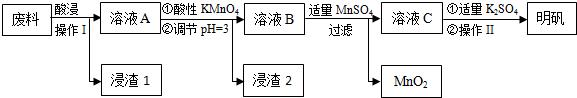
(1)“酸浸”过程中的应选择H2SO4(写酸的化学式).为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有提高反应温度、粉碎等.(写出两条)
(2)操作Ⅰ是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)在溶液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
调节pH=3的目的是使Fe3+转化成Fe(OH)3沉淀,防止Al3+沉淀.此步骤中,可以用H2O2代替KMnO4,写出H2O2的电子式 .
.
(4)只用一种试剂检验溶液A中是否存在Fe2+,该试剂是高锰酸钾酸性溶液或铁氰化钾溶液(写名称).
(5)己知在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+.

(1)“酸浸”过程中的应选择H2SO4(写酸的化学式).为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有提高反应温度、粉碎等.(写出两条)
(2)操作Ⅰ是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)在溶液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
 .
.(4)只用一种试剂检验溶液A中是否存在Fe2+,该试剂是高锰酸钾酸性溶液或铁氰化钾溶液(写名称).
(5)己知在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+.
11.下列过程所涉及到的反应不会出现氧化还原反应的是( )
| A. | 金属钠久置于空气中,先变暗,再变白,又“出汗”,最后变成白色固体 | |
| B. | 由海水制备金属镁和游离态的溴 | |
| C. | 工业上用石灰石、石英、纯碱制玻璃 | |
| D. | 高温下用二氧化硅和碳反应制备粗硅 |
5.下列物质的鉴别方法不正确的是( )
| A. | 用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| D. | 用焰色反应鉴别NaCl、KCl和Na2SO4 |
16.为了实现下列各变化,必须加入还原剂的是( )
| A. | H2O2→H2O | B. | NH4+→NH3 | C. | Fe3+→Fe2+ | D. | CO→CO2 |