题目内容
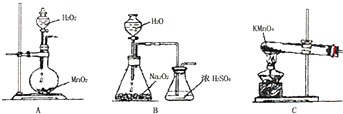
2.污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略).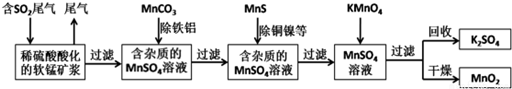
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗;;其中玻璃棒的作用是引流,防止液体溅出.
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀.(只用文字表述)
(3)已知Ksp(CuS)=1.3×10-36,Ksp(NiS)=1.0×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是9.3×10-18mol/L.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式MnO42--e-═MnO4-.
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是bc.(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)废气中SO2与稀硫酸酸化的软锰矿反应的化学方程式为SO2+MnO2=MnSO4;已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3燃煤尾气,可得到硫酸锰晶体(MnSO4•H2O,相对分子质量为169)质量为15.2kg(结果保留3位有效数字).
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等,玻璃棒起引流作用;
(2)从消耗溶液中的酸,促进Al3+和Fe3+水解角度分析;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$,结合Ksp(CuS)计算溶液中Cu2+的浓度;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应;
(5)准确测定一定体积燃煤尾气中SO2含量,利用其还原性及明显的反应现象分析;
(6)SO2与稀硫酸酸化的软锰矿发生氧化还原反应生成硫酸锰;结合硫原子守恒可知,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量.
解答 解:由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等,过滤中玻璃棒的作用为引流,防止液体溅出,
故答案为:漏斗;引流,防止液体溅出;
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$=$\frac{1.4×10{\;}^{-24}}{1×10{\;}^{-5}}$=1.4×10-19,由Ksp(CuS)可知溶液中Cu2+的浓度为$\frac{1.3×10{\;}^{-36}}{1.4×1{0}^{-19}}$=9.3×10-18mol/L,
故答案为:9.3×10-18;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应,则阳极反应为MnO42--e-═MnO4-,
故答案为:MnO42--e-═MnO4-;
(5)准确测定一定体积燃煤尾气中SO2含量,二氧化硫与氨水、NaOH反应不易控制,且加指示剂现象观察的滴定终点与反应终点误差大,而b、c中利用还原性及高锰酸钾褪色、淀粉变蓝等可准确测定气体的含量,
故答案为:bc;
(6)SO2与稀硫酸酸化的软锰矿发生氧化还原反应生成硫酸锰,反应方程式为SO2+MnO2=MnSO4,由硫原子守恒,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量,则硫酸锰晶体的质量为$\frac{1000m{\;}^{3}×6.4g/m{\;}^{3}×90%}{64g/mol}$×169g/mol≈15.2kg,
故答案为:SO2+MnO2=MnSO4; 15.2.
点评 本题以物质的制备实验考查混合物分离提纯的综合应用,为高频考点,涉及氧化还原反应、盐类水解、溶度积计算、原子守恒计算等,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,综合性较强,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 溶质的质量分数为ω=$\frac{a}{{V}_{ρ}-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c(OH-)=$\frac{1000b}{V}$mol•L-1+c(H+) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |

| A. | 溶液与胶体属于包含关系 | |
| B. | 化合物与氧化物属于包含关系 | |
| C. | 电解质与化合物属于交叉关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
| A. | 硝酸银溶液中加入氯化钠:Ag++Cl-═AgCl↓ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
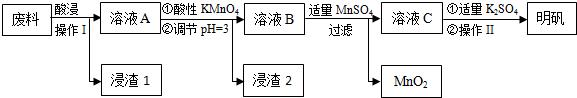
(1)“酸浸”过程中的应选择H2SO4(写酸的化学式).为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有提高反应温度、粉碎等.(写出两条)
(2)操作Ⅰ是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)在溶液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
 .
.(4)只用一种试剂检验溶液A中是否存在Fe2+,该试剂是高锰酸钾酸性溶液或铁氰化钾溶液(写名称).
(5)己知在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+.
| A. | 金属钠久置于空气中,先变暗,再变白,又“出汗”,最后变成白色固体 | |
| B. | 由海水制备金属镁和游离态的溴 | |
| C. | 工业上用石灰石、石英、纯碱制玻璃 | |
| D. | 高温下用二氧化硅和碳反应制备粗硅 |
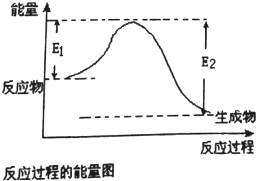 已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题:
已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题: ,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.
,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.