题目内容
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| B、常温下,pH≈5.5的0.1mol/LNaHC2O4溶液:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| C、0.1mol/LNaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) |
| D、室温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、溶液中酸的电离程度和阴离子的水解程度不知无法比较离子浓度大小;
B、常温下,pH≈5.5的0.1mol/LNaHC2O4溶液,电离程度大于水解程度,所以c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4);
C、结合电荷守恒和物料守恒判断;
D、溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3?H2O,V(NaOH)>V(NH4HSO4).
B、常温下,pH≈5.5的0.1mol/LNaHC2O4溶液,电离程度大于水解程度,所以c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4);
C、结合电荷守恒和物料守恒判断;
D、溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3?H2O,V(NaOH)>V(NH4HSO4).
解答:
解:A、25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中,无法判断酸的电离程度和阴离子的水解程度,不能比较离子浓度大小,故A错误;
B、常温下,pH≈5.5的0.1mol/LNaHC2O4溶液,电离程度大于水解程度,所以c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故B错误;
C、NaHS溶液中存在电荷守恒:c(OH-)+c(HS-)+2c(S2-)=c(H+)+c(Na+),物料守恒:c(H2S)+c(HS-)+c(S2-)=c(Na+),二者联式可得:c(OH-)+c(S2-)=c(H+)+c(H2S),故C正确;
D、溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3?H2O,V(NaOH)>V(NH4HSO4),铵根离子水解,则离子浓度大小为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选CD.
B、常温下,pH≈5.5的0.1mol/LNaHC2O4溶液,电离程度大于水解程度,所以c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故B错误;
C、NaHS溶液中存在电荷守恒:c(OH-)+c(HS-)+2c(S2-)=c(H+)+c(Na+),物料守恒:c(H2S)+c(HS-)+c(S2-)=c(Na+),二者联式可得:c(OH-)+c(S2-)=c(H+)+c(H2S),故C正确;
D、溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3?H2O,V(NaOH)>V(NH4HSO4),铵根离子水解,则离子浓度大小为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选CD.
点评:本题考查离子浓度大小的判断,涉及电荷守恒和物料守恒判断,特别是多元弱酸的酸式盐在溶液中存在两种倾向,题目难度较大,注意先发生中和后发生铵根离子与碱反应.

练习册系列答案
相关题目
下列物质属于非电解质的一组是( )
| A、盐酸、食盐、水银 |
| B、水玻璃、冰、火碱 |
| C、纯碱、铜绿、漂白粉 |
| D、干冰、液氨、酒精 |
用NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A、0.5molCl2与铁反应转移电子数为NA |
| B、在标准状况下,NA个任何分子所占的体积均约为22.4L |
| C、300mL 5mol/L KNO3溶液与300mL 5mol/L KCl溶液含有的离子数均约为3NA |
| D、16gO2和O3中所含的氧原子数均为NA |
充分利用已有的数据是解决化学问题方法的重要途径.对数据的利用情况正确的是( )
| A、利用化学平衡常数判断化学反应进行的快慢 |
| B、利用溶解度数据判断氧化还原反应发生的可能性 |
| C、利用沸点数据推测将一些液体混合物分离的可能性 |
| D、利用物质的摩尔质量判断相同状态下不同物质密度的大小 |
下列反应的离子方程式书写正确的是( )
| A、用醋酸溶液除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向FeBr2溶液中通入足量Cl2:Fe3++2Br-+Cl2═Fe3++Br2+2Cl- |
| C、向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3- |
| D、向Ba(OH)2溶液滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
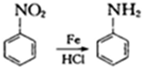
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: NH2+CHC3OOH?
NH2+CHC3OOH? -H2O
-H2O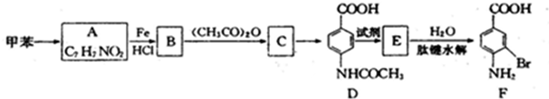
 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位


 CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是