题目内容
汽车尾气中含有NO2、NO和CO等有害气体,现取标准状况下22.4 L汽车尾气,研究发现该气体通过催化转化器后,上述三种有害气体可被完全转化为无害的N2和CO2,再取等体积尾气通入0.1 mol/L 50 mLNaOH溶液中,其中的NO2和NO恰好被完全吸收.则尾气中CO的体积分数可能为(说明:汽车尾气中其它成分气体与CO和NaOH溶液均不反应)( )
| A、0.4% | B、0.8% |
| C、2% | D、4% |
考点:有关混合物反应的计算
专题:
分析:尾气通入氢氧化钠反应时,NO2和NO恰好被完全吸收,发生反应:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,由元素守恒可知:钠原子与氮原子物质的量相等,即n(NO2+NO)=n(NaOH),据此计算混合气体中V(NO2+NO);
尾气通过催化转换器时,发生反应:4CO+2NO2═N2+4CO2,2CO+2NO═N2+2CO2,由方程式可知,全部为NO2时,CO的体积最大,全部为NO时,CO的体积最小,进而计算CO体积,再计算CO体积分数范围.
尾气通过催化转换器时,发生反应:4CO+2NO2═N2+4CO2,2CO+2NO═N2+2CO2,由方程式可知,全部为NO2时,CO的体积最大,全部为NO时,CO的体积最小,进而计算CO体积,再计算CO体积分数范围.
解答:
解:发生反应:4CO+2NO2═N2+4CO2,2CO+2NO═N2+2CO2,
尾气通入氢氧化钠反应时,NO2和NO恰好被完全吸收,发生反应:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,由元素守恒可知:钠原子与氮原子物质的量相等,即n(NO2+NO)=n(NaOH)=0.05L×0.1mol/L=0.005mol,故V(NO2+NO)=0.005L×22.4L/mol=0.112L,
尾气通过催化转换器时,发生反应:4CO+2NO2═N2+4CO2,2CO+2NO═N2+2CO2,由方程式可知:
全部为NO2时,CO的体积最大,CO体积最大为0.112L×2=0.224L,故CO体积分数最大值为
×100%=1%;
全部为NO时,CO的体积最小,CO体积最小为0.112L,故CO体积分数最小值为
×100%=0.5%;
故CO体积分数范围介于0.5%~1%之间,
故选B.
尾气通入氢氧化钠反应时,NO2和NO恰好被完全吸收,发生反应:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,由元素守恒可知:钠原子与氮原子物质的量相等,即n(NO2+NO)=n(NaOH)=0.05L×0.1mol/L=0.005mol,故V(NO2+NO)=0.005L×22.4L/mol=0.112L,
尾气通过催化转换器时,发生反应:4CO+2NO2═N2+4CO2,2CO+2NO═N2+2CO2,由方程式可知:
全部为NO2时,CO的体积最大,CO体积最大为0.112L×2=0.224L,故CO体积分数最大值为
| 0.224L |
| 22.4L |
全部为NO时,CO的体积最小,CO体积最小为0.112L,故CO体积分数最小值为
| 0.112L |
| 22.4L |
故CO体积分数范围介于0.5%~1%之间,
故选B.
点评:本题考查混合物计算,关键是利用原子守恒计算二氧化氮与NO总体积,再利用极限法进行分析解答,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
某同学组装了如图所示的电化学装置,电极材料Ⅰ-Ⅳ均为石墨,闭合K后,下列叙述正确的是( )
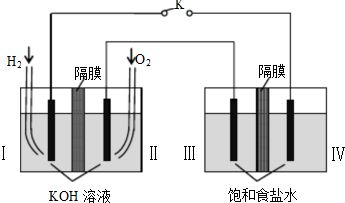

| A、电子流动方向:电极Ⅳ-Ⅰ |
| B、电极Ⅱ电极反应式:O2+2H2O+4e-=4OH- |
| C、电极Ⅲ发生还原反应 |
| D、电极Ⅳ附近观察到黄绿色气体 |
已知乙醇、乙酸、正丁醇、乙酸乙酯、乙酸正丁酯的沸点如下:
下列关于实验室制备乙酸乙酯和乙酸正丁酯的描述正确的是( )
| 物质 | 乙酸 | 乙醇 | 正丁醇 | 乙酸乙酯 | 乙酸正丁酯 |
| 沸点(0C) | 117.9 | 78.5 | 117.7 | 77 | 126 |
| A、均采用水浴加热 |
| B、制备乙酸正丁酯时正丁醇过量 |
| C、均采用边反应边蒸馏的方法 |
| D、制备乙酸乙酯时乙醇过量 |
下图表示4-溴-1-环己醇所发生的4个不同反应(反应条件略去),产物含有二种官能团的反应是(


| A、②③ | B、①④ |
| C、①②④ | D、①②③④ |



