题目内容
某同学组装了如图所示的电化学装置,电极材料Ⅰ-Ⅳ均为石墨,闭合K后,下列叙述正确的是( )
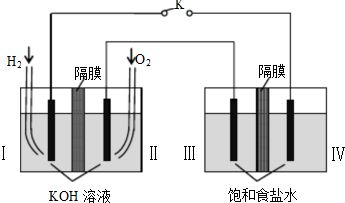

| A、电子流动方向:电极Ⅳ-Ⅰ |
| B、电极Ⅱ电极反应式:O2+2H2O+4e-=4OH- |
| C、电极Ⅲ发生还原反应 |
| D、电极Ⅳ附近观察到黄绿色气体 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据图表分析,左边为氢氧燃料电池,Ⅰ为负极氢气失电子发生氧化反应,Ⅱ为氧气得电子发生还原反应,右边为电解池,Ⅲ为与正极氧气相连为阳极,氯离子失电子发生氧化反应,Ⅳ为与负极氢气相连为阴极,氢离子得电子发生还原反应,据此分析解答.
解答:
解:A、根据以上分析,Ⅳ为与负极氢气相连为阴极,氢离子得电子发生还原反应,所以电子流动方向:电极Ⅰ-Ⅳ,故A错误;
B、Ⅱ为氧气得电子发生还原反应,反应式:O2+2H2O+4e-=4OH-,故B正确;
C、Ⅲ为与正极氧气相连为阳极,氯离子失电子发生氧化反应,故C错误;
D、Ⅳ为与负极氢气相连为阴极,氢离子得电子发生还原反应生成氢气,故D错误;
故选:B.
B、Ⅱ为氧气得电子发生还原反应,反应式:O2+2H2O+4e-=4OH-,故B正确;
C、Ⅲ为与正极氧气相连为阳极,氯离子失电子发生氧化反应,故C错误;
D、Ⅳ为与负极氢气相连为阴极,氢离子得电子发生还原反应生成氢气,故D错误;
故选:B.
点评:本题考查了电解池、原电池的原理及应用,难度不大,掌握基础是关键.

练习册系列答案
相关题目
汽车尾气中含有NO2、NO和CO等有害气体,现取标准状况下22.4 L汽车尾气,研究发现该气体通过催化转化器后,上述三种有害气体可被完全转化为无害的N2和CO2,再取等体积尾气通入0.1 mol/L 50 mLNaOH溶液中,其中的NO2和NO恰好被完全吸收.则尾气中CO的体积分数可能为(说明:汽车尾气中其它成分气体与CO和NaOH溶液均不反应)( )
| A、0.4% | B、0.8% |
| C、2% | D、4% |
某同学通过系列实验探究铝及其化合物的性质,操作正确且能达到目的是( )
| A、将浓氨水缓慢滴入Al2(SO4)3溶液时候,观察Al(OH)3沉淀的生成和溶解 |
| B、将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| C、将Al(OH)3沉淀转入蒸发皿中,加热至无水蒸气逸出,得氧化铝固体 |
| D、分别向Al(OH)3沉淀中加入稀硫酸和NaOH溶液,探究Al(OH)3的两性 |
下列实验操作或装置(略去部分夹持仪器)正确的是( )
A、 乙酸乙酯的制备 |
B、 除去CO2中少量HCl |
C、 配制溶液 |
D、 中和热测定 |
常温下,0.1mol/LHF溶液的pH=2,则该溶液中有关粒子浓度关系式不正确的是( )
| A、c(H+)>c(F-) |
| B、c(H+)>c(HF) |
| C、c(HF)>c(OH-) |
| D、c(HF)>c(F-) |