题目内容
现有部分元素的性质与原子(或分子)结构如下表:
(1)写出元素T的原子结构示意图 .
(2)元素Y与元素Z相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号).
A.Y单质的熔点比Z单质低B.Y的化合价比Z低C.Y单质与水反应比Z单质剧烈D.Y最高价氧化物的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,写出该化合物的化学式 ,该化合物与CO2反应的化学方程式为 .
(5)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 .
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
(2)元素Y与元素Z相比,金属性较强的是
A.Y单质的熔点比Z单质低B.Y的化合价比Z低C.Y单质与水反应比Z单质剧烈D.Y最高价氧化物的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,写出该化合物的化学式
(5)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:T原子的最外层电子数是次外层电子数的3倍,则T最外层含有6个电子,为O元素;
X能形成双原子分子,分子内原子间存在3对共用电子对,则X是N元素;
Y的M层比K层少1个电子,K层含有2个电子,则M层含有1个电子,故Y为Na元素;
Z是第3周期元素的简单离子中半径最小的,则Z为Al元素,据此结合元素周期律知识进行解答.
X能形成双原子分子,分子内原子间存在3对共用电子对,则X是N元素;
Y的M层比K层少1个电子,K层含有2个电子,则M层含有1个电子,故Y为Na元素;
Z是第3周期元素的简单离子中半径最小的,则Z为Al元素,据此结合元素周期律知识进行解答.
解答:
解:T原子的最外层电子数是次外层电子数的3倍,则T最外层含有6个电子,为O元素;X能形成双原子分子,分子内原子间存在3对共用电子对,则X是N元素;Y的M层比K层少1个电子,则M层含有1个电子,Y为Na元素;Z是第3周期元素的简单离子中半径最小的,则Z为Al元素,
(1)T为O元素,氧原子的原子序数为8,其原子结构示意图为: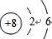 ,故答案为:
,故答案为: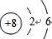 ;
;
(2)Y为Na、Z为Al元素,金属性大小为:Na>Al,
A.Y单质的熔点比Z单质低:熔点高低与单质金属性没有必然关系,故A错误;
B.Y的化合价比Z低:化合价高低与元素金属性没有必然关系,故B错误;
C.Y单质与水反应比Z单质剧烈,说明Y单质金属性强,故C正确;
D.Y最高价氧化物的水化物的碱性比Z的强,能够证明Y的金属性大于Z,故D正确;
故答案为:Na;CD;
(3)T、X、Y、Z分别为O、N、Na、Al,其中有两种元素能形成既有离子键又有共价键的化合物,该混合物为Na2O2,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:Na2O2;2Na2O2+2CO2=2Na2CO3+O2;
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q为H2O2,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W为N2H4,H2O2与N2H4发生氧化还原反应,生成X单质为N2和T的另一种氢化物为H2O,则该反应的化学方程式为N2H4+2H2O2=N2+4H2O,
故答案为:N2H4+2H2O2=N2+4H2O.
(1)T为O元素,氧原子的原子序数为8,其原子结构示意图为:
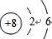 ,故答案为:
,故答案为: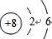 ;
;(2)Y为Na、Z为Al元素,金属性大小为:Na>Al,
A.Y单质的熔点比Z单质低:熔点高低与单质金属性没有必然关系,故A错误;
B.Y的化合价比Z低:化合价高低与元素金属性没有必然关系,故B错误;
C.Y单质与水反应比Z单质剧烈,说明Y单质金属性强,故C正确;
D.Y最高价氧化物的水化物的碱性比Z的强,能够证明Y的金属性大于Z,故D正确;
故答案为:Na;CD;
(3)T、X、Y、Z分别为O、N、Na、Al,其中有两种元素能形成既有离子键又有共价键的化合物,该混合物为Na2O2,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:Na2O2;2Na2O2+2CO2=2Na2CO3+O2;
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q为H2O2,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W为N2H4,H2O2与N2H4发生氧化还原反应,生成X单质为N2和T的另一种氢化物为H2O,则该反应的化学方程式为N2H4+2H2O2=N2+4H2O,
故答案为:N2H4+2H2O2=N2+4H2O.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,明确常见化学用语的概念及表示方法.

练习册系列答案
相关题目
过滤还带灰制取单质碘的实验中,设计的操作正确的且能达到实验目的是( )
A、 装置,过滤海带灰浸取液 装置,过滤海带灰浸取液 |
B、 装置,在滤液中通入Cl2 装置,在滤液中通入Cl2 |
C、 装置,先放出下层液体,再从下口放出有机层 装置,先放出下层液体,再从下口放出有机层 |
D、 装置,回收萃取剂苯并获得单质碘 装置,回收萃取剂苯并获得单质碘 |


