题目内容
8.目前人们对环境保护、新能源开发很重视.(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200 kJ•mol-1
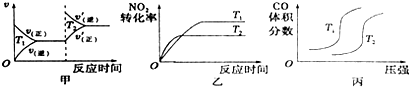
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 浓度/mol.L-1/时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L-1的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
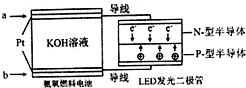
请写出通入a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6 mol.
分析 (1)该反应中焓变小于0,为放热反应,升高温度,正逆反应速率都增大,且反应向着逆向进行,二氧化氮转化率减小、一氧化碳的体积含量减小,据此对各图象进行判断;
(2)①分析图表数据,根据V=$\frac{△c}{t}$计算得到反应速率,根据k=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$计算;
②依据图表数据分析,结合平衡浓度计算平衡常数和浓度变化分析判断,30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)?N2(g)+CO2(g),依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为5:3:3,氮气和二氧化碳难度之比始终为1:1,所以5:3>4:3,说明平衡向逆反应方向移动;
(3)由已知热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式;
(4)由反应可知,负极上氨气失去电子生成氮气,根据电子与氨气的物质的量关系计算.
解答 解:(1)该反应为放热反应,升高温度,正逆反应速率均增大,都应该离开原来的速率点,图象与实际情况不相符,故甲错误;
升高温度,反应向着逆向进行,反应物的转化率减小,反应速率加快,图象与实际反应一致,故乙正确,
压强相同时,升高温度,反应向着逆向移动,一氧化氮的体积分数应该增大,图象与实际不相符,故丙错误,
故答案为:乙;
(2)①0~20min内,CO2的平均反应速率v(CO2)=$\frac{0.3mol/L}{20min}$=0.015mol•L-1•min-1;
故答案为:0.015mol•L-1•min-1;
C(s)+2NO(g)?N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$=$\frac{0.3×0.3}{0.{4}^{2}}$=0.56;
故答案为:0.015mol•L-1•min-1;0.56;
②30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)?N2(g)+CO2(g),依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$=$\frac{0.3×0.3}{0.{4}^{2}}$=0.56,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;
a.加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故a错误;
b.通入一定量的NO,新平衡状态下物质平衡浓度增大,故b正确;
c.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故c正确;
d.加入合适的催化剂,催化剂只改变化学反应速率,不改变化学平衡,故d错误;
故答案为:bc;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为5:3:3,氮气和二氧化碳难度之比始终为1:1,所以5:3>4:3,说明平衡向逆反应方向移动,达到新平衡时NO的转化率,说明逆反应是吸热反应,则正反应是放热反应;
故答案为:降低;<;
(3)①2NH3(g)+CO2(g)→NH2CO2 NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)→CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)→H2O(g)△H=+44.0kJ/mol
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1;
(4)电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,负极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3即0.2mol,转移电子的物质的量为0.6mol;
故答案为:2NH3+6OH--6e-=N2+6H2O;0.6mol.
点评 本题考查了盖斯定律的应用、原电池原理的应用、影响平衡移动的因素、平衡常数的有关计算等,综合性较强,侧重分析及计算能力的考查,把握化学平衡常数的有关计算以及原电池原理、电极反应为解答的关键,题目难度中等.

| A. | 定容时俯视刻度线 | |
| B. | 移液前容量瓶不干燥 | |
| C. | 定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补几滴蒸馏水 | |
| D. | 溶解所称NaCl并移液后,用蒸馏水洗涤烧杯2~3次,洗涤液转移至容量瓶中 |
| A. | Cu与过量浓HNO3反应,生成的气体呈红棕色 | |
| B. | 足量H2通过灼热的CuO粉末后,生成的固体为红色 | |
| C. | AgNO3溶液与足量Na2S溶液反应后再滴加NaCl溶液,沉淀为白色 | |
| D. | 物质的量相同的CH3COOH与NaOH反应后滴加酚酞,溶液显红色 |
| A. | 使湿润的蓝色石蕊试纸变红的气体是氨气 | |
| B. | 瓷坩埚可用作Na2CO3与石英制Na2SiO3的反应容器 | |
| C. | 热Na2CO3溶液更利于清洗餐具上的油污 | |
| D. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的沉淀,该溶液一定含有SO42- |
| A. | 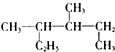 的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 樱桃中含有一种羟基酸(如图所示)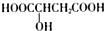 ,该羟基酸可以发生取代、氧化和缩聚等反应 ,该羟基酸可以发生取代、氧化和缩聚等反应 | |
| C. | 所有的糖、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 等质量的甲醛和乙酸充分燃烧耗氧量相同 |
其合成乙烯的反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g);△H. 几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
| 物质 | H2(g) | CO2(g) | CH2=CH2 | H2O(g) |
| 能量:KJ/mol | 0 | -394 | 52 | -242 |
(2)以稀硫酸为电解质溶液,利用太阳能也可将CO2转化为低碳烯烃,工作原理图如图1.

①b电极的名称是正极.②产生丙烯的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
(3)工业上采用CO2与乙苯脱氢生产重要化工原料苯乙烯,反应如下:
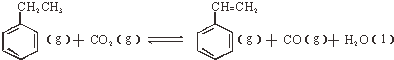 ;△H<0
;△H<0①下列叙述能说明乙苯与CO2反应已达到平衡状态的是ad.
a.恒温恒压时气体密度不变b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成 1mol H2O
d.CO2的体积分数保持不变
②在2L密闭容器内,CO2与乙苯发生反应.在三种不同的条件下进行实验,CO2、乙苯的起始浓度均分别为3mol/L和1mol/L,其中实验I在T1°C、P1 Pa下,而实验Ⅱ、Ⅲ分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图2所示.则:实验ⅠCO2在0-50min时的反应速率为0.012mol/(L•min).
实验Ⅲ可能改变的条件是升高温度.
③实验Ⅰ达到平衡后,在该温度下,向该容器中再通入CO2和乙苯各1mol,重新达到平衡时,乙苯的转化率将减少(填“增大”、“减小”或“不变”),此时平衡常数为0.375.
| A. | 硅胶可作食品干燥剂 | B. | 计算机芯片的主要材料是SiO2 | ||
| C. | 糖类物质都属于高分子化合物 | D. | 地沟油和矿物油都属于酯类物质 |

 +(CH3CO)2O→
+(CH3CO)2O→ +CH3COOH.
+CH3COOH. ;D的结构简式为
;D的结构简式为 .
. (填结构简式)
(填结构简式) 为起始原料制备
为起始原料制备 的合成路线:
的合成路线: $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$ $→_{Cu/△}^{O_{2}}$
$→_{Cu/△}^{O_{2}}$ $→_{H_{3}PO_{4}}^{浓HNO_{3}}$
$→_{H_{3}PO_{4}}^{浓HNO_{3}}$ $\stackrel{NaBH_{4}}{→}$
$\stackrel{NaBH_{4}}{→}$