题目内容
18.配制250mL0.1mol•L-1的NaCl溶液时,下列实验操作会使所配溶液浓度偏大的是( )| A. | 定容时俯视刻度线 | |
| B. | 移液前容量瓶不干燥 | |
| C. | 定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补几滴蒸馏水 | |
| D. | 溶解所称NaCl并移液后,用蒸馏水洗涤烧杯2~3次,洗涤液转移至容量瓶中 |
分析 分析操作对溶质的物质的量n和溶液的体积V的影响,依据C=$\frac{n}{V}$可知,凡是使n偏大或者使V偏小的操作,溶液浓度都会偏大,反之溶液浓度偏小,据此解答.
解答 解:A.定容时俯视刻度线,导致溶液体积偏小,则溶液浓度偏高,故A选;
B.移液前容量瓶不干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故B不选;
C.定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补几滴蒸馏水,导致溶液体积偏大,溶液浓度偏小,故C不选;
D.解所称NaCl并移液后,用蒸馏水洗涤烧杯2~3次,洗涤液转移至容量瓶中,操作正确,溶液的浓度准确,故D不选;
故选:A.
点评 本题考查了一定物质的量浓度溶液配制误差分析,明确操作对溶质的物质的量n和溶液的体积V的影响依据C=$\frac{n}{V}$进行误差分析即可解答,题目难度不大.

练习册系列答案
相关题目
4.下列实验设计、操作或实验现象不合理的是( )
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| C. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 | |
| D. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 |
6.胶体区别与其他分散系的本质特征是( )
| A. | 能发生丁达尔现象 | |
| B. | 胶体粒子能通过滤纸空隙 | |
| C. | 胶体在一定条件下能稳定存在 | |
| D. | 胶体分散质粒子直径在1nm~100nm之间 |
13.下列能在无色溶液中大量共存的离子组是( )
| A. | Na+、Ba2+、CO32-、NO3- | B. | Na+、OH-、K+、MnO4- | ||
| C. | K+、HCO3-、SO42-、Na+ | D. | H+、Cl-、Cu2+、SO42- |
10.NA为阿伏伽德罗常数的值.下列说法中不正确的是( )
| A. | 18g冰晶体中含有氢键的数目为2NA | |
| B. | 1molH2O2中含有非极性键的数目为NA | |
| C. | 1molSiO2晶体中含有Si-O键的数目为4NA | |
| D. | 22.4LHF(标准状况)中含有氟原子的数目为NA |
7.下列有关热化学方程式的书写及对应的表达均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量,则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
8.目前人们对环境保护、新能源开发很重视.
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200 kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).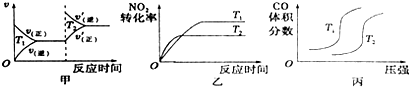
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
①根据图表数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)=0.015 mol•L-1•min-1;计算该反应的平衡常数K=0.56.
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L-1的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
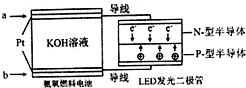
请写出通入a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6 mol.
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200 kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).

(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 浓度/mol.L-1/时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L-1的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;

请写出通入a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6 mol.
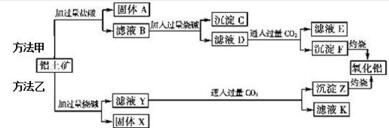
 甲、乙、丙三种物质之间有如下转化关系(如图):
甲、乙、丙三种物质之间有如下转化关系(如图):