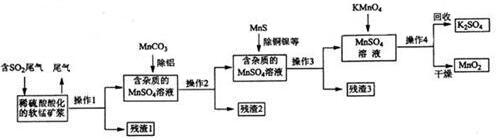
题目内容
19.下列反应描述错误的是( )| A. | Cu与过量浓HNO3反应,生成的气体呈红棕色 | |
| B. | 足量H2通过灼热的CuO粉末后,生成的固体为红色 | |
| C. | AgNO3溶液与足量Na2S溶液反应后再滴加NaCl溶液,沉淀为白色 | |
| D. | 物质的量相同的CH3COOH与NaOH反应后滴加酚酞,溶液显红色 |
分析 A.铜和浓硝酸反应生成红棕色气体二氧化氮;
B.氢气具有还原性,能还原黑色的CuO生成红色的Cu;
C.硫化钠和硝酸银反应生成黑色的硫化银沉淀,硫化银不能转化为AgCl白色沉淀;
D.物质的量相同的醋酸和NaOH恰好完全反应生成醋酸钠,醋酸钠溶液呈碱性而使酚酞试液变红色.
解答 解:A.浓硝酸具有强氧化性,铜和浓硝酸反应生成红棕色气体二氧化氮,所以生成的气体呈红棕色,故A正确;
B.氢气具有还原性,能还原黑色的CuO生成红色的Cu,看到的现象是:固体由黑色变为红色,故B正确;
C.硫化银溶解度小于氯化银,硫化钠和硝酸银反应生成黑色的硫化银沉淀,所以硫化银不能转化为AgCl白色沉淀,故C错误;
D.物质的量相同的醋酸和NaOH恰好完全反应生成醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解而导致溶液呈碱性,所以醋酸钠溶液使酚酞试液变红色,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,涉及物质性质、难溶物转化、盐类水解等知识点,侧重考查学生分析判断及实验操作能力,题目难度不大.

练习册系列答案
相关题目
10.NA为阿伏伽德罗常数的值.下列说法中不正确的是( )
| A. | 18g冰晶体中含有氢键的数目为2NA | |
| B. | 1molH2O2中含有非极性键的数目为NA | |
| C. | 1molSiO2晶体中含有Si-O键的数目为4NA | |
| D. | 22.4LHF(标准状况)中含有氟原子的数目为NA |
7.下列有关热化学方程式的书写及对应的表达均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量,则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
11.被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体,在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2十H2O═ZnO+2MnO(OH).下列说法正确的是( )
| A. | 该电池的负极锌发生还原反应 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.lmol Zn完全溶解时,流经电解液的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为 MnO2+e-+H20═MnO(OH)+OH- |
8.目前人们对环境保护、新能源开发很重视.
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200 kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).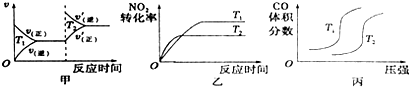
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
①根据图表数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)=0.015 mol•L-1•min-1;计算该反应的平衡常数K=0.56.
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L-1的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
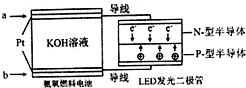
请写出通入a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6 mol.
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200 kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).

(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 浓度/mol.L-1/时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L-1的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;

请写出通入a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6 mol.
9.下列说法正确的是( )
| A. | C8H10含苯环的烃同分异构体有3种 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯 | |
| C. | 苯中含有杂质苯酚,可用浓溴水来除杂 | |
| D. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物是同系物 |
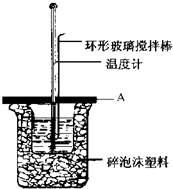 如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).
如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).