题目内容
13.实验室用足量锌粒与一定量的2mol/L硫酸溶液反应制取氢气,下列措施既能减小化学反应速率,又不影响氢气产量的选项是( )| A. | 用锌粒代替锌粉 | B. | 向其中加入少量1mol/L硫酸溶液 | ||
| C. | 向其中加入氯化钠溶液 | D. | 向其中加入等体积的水 | ||
| E. | 向其中加入碳酸钠溶液 | F. | 向其中加入硝酸钠溶液 |
分析 降低反应速率,可降低浓度、温度等,不影响生成氢气的总量,则溶液中氢离子的物质的量不变,以此解答该题.
解答 解:A.用锌粒代替锌粉,固体表面积减小,反应速率减小,故选;
B.向其中加入少量1mol/L硫酸溶液,生成氢气的量增多,故B不选;
C.向其中加入氯化钠溶液,氢离子浓度降低,反应速率减小,故C选;
D.向其中加入等体积的水,氢离子浓度降低,反应速率减小,故D选;
E.向其中加入碳酸钠溶液,消耗酸,生成氢气的总量减小,故E不选;
F.向其中加入硝酸钠溶液,酸性条件下硝酸根离子具有强氧化性,生成NO,不生成氢气,故D不选.
故选ACD.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与铁发生钝化反应的性质,为易错点.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
3.下列说法中正确的是( )
| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 所有的物质中均含有化学键 |
4.两种气态烃的混合物共0.1mol,充分燃烧后得3.584L(标准状况下)CO2和3.6g水,下列说法正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 可能有乙烷 | D. | 一定有丙炔 |
1.已知,某元素+1价离子的电子排布式为:1s22s22p6,则下列叙述错误的是( )
| A. | 该元素位于周期表的第二周期0族 | |
| B. | 该元素最高价氧化物对应水化物为强碱 | |
| C. | 该元素第一电离能为本周期最小 | |
| D. | 该元素电负性为短周期最小 |
18.下列各组物质中,只要总质量一定,不论以何种比例混和,完全燃烧生成 CO2 和水的质量也总是定值是( )
| A. | C3H8 和 C3H6 | B. | C2H6 和 C3H6 | C. | C2H4 和 C4H8 | D. | CH4 和 C2H6 |
5.下列表示物质结构的化学用语或模型中,不正确的是( )
| A. | 8个中子的碳原子的核素符号:14C | |
| B. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | Cl-离子的结构示意图 | |
| D. | 氯化钠的电子式: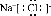 |
2.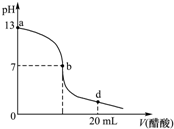 常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
 常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )| A. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 | |
| B. | 在b点,c(Na+)=c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c (Na+)>c (H+)>c (OH-) | |
| D. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L |
3.有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是( )

则甲、乙、丙三种溶液可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、BaCl2 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |