题目内容
5.下列表示物质结构的化学用语或模型中,不正确的是( )| A. | 8个中子的碳原子的核素符号:14C | |
| B. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | Cl-离子的结构示意图 | |
| D. | 氯化钠的电子式: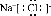 |
分析 A.质量数=质子数+中子数,元素符号的左上角为质量数;
B.碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开;
C.氯离子的核电荷数为17,核外电子总数为18,最外层满足8电子稳定结构;
D.氯化钠为离子化合物,阴阳离子需要标出所带电荷,氯离子还需要标出最外层电子.
解答 解:A.8个中子的碳原子的质量数=8+6=14,该核素的符号为:14C,故A正确;
B.碳酸氢钠在溶液中完全电离,碳酸氢根离子不能拆开,其电离方程式为:NaHCO3=Na++HCO3-,故B错误;
C.Cl-离子最外层达到8电子稳定结构,氯离子的结构示意图为 ,故C正确;
,故C正确;
D.氯化钠为离子化合物,钠离子之间用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化钠的电子式为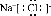 ,故D正确;
,故D正确;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、电离方程式、元素符号等知识,明确常见化学用语的概念及书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15. 如图所示的原电池中:
如图所示的原电池中:
①导线中电子的流向Cu→Ag,
②溶液中阳离子的移动方向向银电极移动,
③正极的电极反应式为Ag++e-=Ag,
④电池工作时总反应的离子方程式是Cu+2Ag+═2Ag+Cu2+.
 如图所示的原电池中:
如图所示的原电池中:①导线中电子的流向Cu→Ag,
②溶液中阳离子的移动方向向银电极移动,
③正极的电极反应式为Ag++e-=Ag,
④电池工作时总反应的离子方程式是Cu+2Ag+═2Ag+Cu2+.
16.下列各组物质,可以直接用分液漏斗分离的是( )
| A. | 酒精和碘 | B. | 硝基苯和水 | C. | 乙醇和水 | D. | 溴和溴苯 |
13.实验室用足量锌粒与一定量的2mol/L硫酸溶液反应制取氢气,下列措施既能减小化学反应速率,又不影响氢气产量的选项是( )
| A. | 用锌粒代替锌粉 | B. | 向其中加入少量1mol/L硫酸溶液 | ||
| C. | 向其中加入氯化钠溶液 | D. | 向其中加入等体积的水 | ||
| E. | 向其中加入碳酸钠溶液 | F. | 向其中加入硝酸钠溶液 |
10.已知反应:X+Y=M+N 为放热反应,对该反应的下列说法正确的是( )
| A. | X和Y的总能量一定高于M和N的总能量 | |
| B. | X能量一定高于Y | |
| C. | 因该反应为放热反应,故不必加热就可发生 | |
| D. | Y能量一定高于N |
17.下列微粒能促进水的电离的是( )
| A. | H3O+ | B. | OH- | C. | NO3- | D. | NH4+ |
14.有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中无沉淀,加入Na2CO3溶液中有白色沉淀 | |
| D. | 等浓度的两种盐溶液分别与等浓度的盐酸反应,碳酸氢钠溶液的反应速率快 |
 为了探究实验室制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置
为了探究实验室制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置