题目内容
2.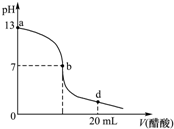 常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )| A. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 | |
| B. | 在b点,c(Na+)=c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c (Na+)>c (H+)>c (OH-) | |
| D. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L |
分析 未加醋酸时,NaOH溶液的pH=13,NaOH是强碱,则该溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L;
醋酸钠是强碱弱酸盐,其水溶液呈碱性,所以醋酸和NaOH恰好完全反应的溶液呈碱性;
d点时,n(醋酸)=0.2mol/L×0.02L=0.004mol>n(NaOH)=0.1mol/L×0.02L=0.002mol,该点溶液中溶质为等物质的量浓度的醋酸钠和醋酸,且醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性;
任何溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:未加醋酸时,NaOH溶液的pH=13,NaOH是强碱,则该溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L;
醋酸钠是强碱弱酸盐,其水溶液呈碱性,所以醋酸和NaOH恰好完全反应的溶液呈碱性;
d点时,n(醋酸)=0.2mol/L×0.02L=0.004mol>n(NaOH)=0.1mol/L×0.02L=0.002mol,该点溶液中溶质为等物质的量浓度的醋酸钠和醋酸,且醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性;
A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,所以醋酸和NaOH恰好完全反应的溶液呈碱性,所以氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线a、b间的某点,故A错误;
B.b点溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(Na+)=c(CH3COO-),故B正确;
C.点时,n(醋酸)=0.2mol/L×0.02L=0.004mol>n(NaOH)=0.1mol/L×0.02L=0.002mol,该点溶液中溶质为等物质的量浓度的醋酸钠和醋酸,且醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c (Na+)>c (H+)>c (OH-),故C正确;
D.根据以上分析知,c(NaOH)=0.1mol/L,故D正确;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确曲线上溶液中的溶质及其性质是解本题关键,题目难度不大.

 名校课堂系列答案
名校课堂系列答案①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能.
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ①③⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
| A. | 用锌粒代替锌粉 | B. | 向其中加入少量1mol/L硫酸溶液 | ||
| C. | 向其中加入氯化钠溶液 | D. | 向其中加入等体积的水 | ||
| E. | 向其中加入碳酸钠溶液 | F. | 向其中加入硝酸钠溶液 |
| A. | X和Y的总能量一定高于M和N的总能量 | |
| B. | X能量一定高于Y | |
| C. | 因该反应为放热反应,故不必加热就可发生 | |
| D. | Y能量一定高于N |
| A. | H3O+ | B. | OH- | C. | NO3- | D. | NH4+ |
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中无沉淀,加入Na2CO3溶液中有白色沉淀 | |
| D. | 等浓度的两种盐溶液分别与等浓度的盐酸反应,碳酸氢钠溶液的反应速率快 |
| A. | 甲酸乙酯 | B. | 乙酸甲酯 | C. | 乙酸丙酯 | D. | 丙酸丁酯 |
(一)制备α-氯乙基苯的反应如下:
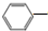 CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$
CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$ CHCl-CH3(g)+HCl(g)△H>0
CHCl-CH3(g)+HCl(g)△H>0T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯摩尔分数随时间变化如下表所示:
| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为b(填曲线标记字母),其判断理由是正反应为吸热反应,其他条件不变,温度升高K变大.
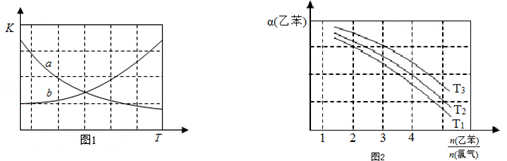
(3)乙苯的平衡转化率α(乙苯)随反应物投料比和温度的关系如图2所示,图2中的温度由大到小为T3>T2>T1,其判断理由是正反应为吸热反应,其他条件不变,温度升高,平衡正向移动,乙苯转化率增加.
(二)催化脱氢生产苯乙烯的反应如下:
 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)△H=+124kJ/mol
CH=CH2(g)+H2(g)△H=+124kJ/mol(4)气相反应的化学平衡常数有多种表示方法,可用各气体摩尔分数代替浓度项表示平衡常数,写出上述反应的平衡常数表达式Kχ=$\frac{λ(氢气)λ(苯乙烯)}{λ(乙苯)}$.(用符号χ表示气体摩尔分数).
(5)工业上,在恒压条件下进行上述反应时,将乙苯与水蒸气的混合气体通入反应器中(已知水蒸气不参与反应),加入水蒸气可以使乙苯的转化率增大,用化学平衡理论解释乙苯转化率增加的原因恒压条件,加水蒸气体积增大,相当于减压,平衡向气体分子数增大的方向移动,即正向移动,乙苯转化率增加.