题目内容
17.下列物质相互混合后,不会发生离子反应的是( )| A. | Na2SO4溶液和MgCl2溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | NaOH溶液和Fe(SO4)3溶液 | D. | Ca(OH)2溶液和盐酸 |
分析 A.二者混合不生成沉淀、气体、水等;
B.反应生成二氧化碳;
C.反应生成氢氧化铁沉淀;
D.反应生成氯化钙和水.
解答 解:A.Na2SO4溶液和MgCl2溶液,不反应,故A选;
B.Na2CO3溶液和稀硫酸,反应生成气体,可发生离子反应,故B不选;
C.NaOH溶液和Fe(SO4)3溶液,可发生离子反应生成沉淀,故C不选;
D.Ca(OH)2溶液和盐酸可发生离子反应生成盐和水,故D不选;
故选A.
点评 本题考查钠的化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应发生的条件,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.根据以下3个热化学方程式:2H2S(g)+3O2(g)→2SO2(g)+2H2O(l)+Q1kJ;2H2S(g)+O2(g)→2S(s)+2H2O(l)+Q2kJ;2H2S(g)+O2(g)→2S(s)+2H2O(g)+Q3kJ.判断Q1、Q2、Q3三者关系正确的是( )
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
5.已知乙炔与苯蒸气完全燃烧的热化学方程式分别如下:
①2C2H2(g)+5O2(g)═4CO2(g)+2H2O(1)△H=-2600KJ/mol
②2C6H6(g)+15O2(g)═6CO2(g)+6H2O(1)△H=-6590KJ/mol
下列说法正确的是( )
①2C2H2(g)+5O2(g)═4CO2(g)+2H2O(1)△H=-2600KJ/mol
②2C6H6(g)+15O2(g)═6CO2(g)+6H2O(1)△H=-6590KJ/mol
下列说法正确的是( )
| A. | 2mol C2H2(g)完全燃烧生成气态水时放热大于2600kJ | |
| B. | 2mol C6H6(1)完全燃烧生成液态水时放热大于6590kJ | |
| C. | 相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 | |
| D. | C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
12.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,4.6g乙醇(CH3CH2OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出136.68kJ的热量,试写出表示乙醇燃烧热的热化学方程式:CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8kJ/mol
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键双会释放能量.
已知反应N2(g)+3H2(g)═2NH3(g)△H=akJ•mol-1.
试根据表中所列键能数据计算a的数值:-93
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(石墨,s)+O2(g)═CO2(g)H1=-393.5kJ•mol-1①2H2(g)+O2(g)═2H2O(l)H2=-571.6kJ•mol-1②2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖期定律,计算298K时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的焓变+227.7kJ•mol-.(写出简要的计算过程).
(1)实验测得,4.6g乙醇(CH3CH2OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出136.68kJ的热量,试写出表示乙醇燃烧热的热化学方程式:CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8kJ/mol
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键双会释放能量.
已知反应N2(g)+3H2(g)═2NH3(g)△H=akJ•mol-1.
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(石墨,s)+O2(g)═CO2(g)H1=-393.5kJ•mol-1①2H2(g)+O2(g)═2H2O(l)H2=-571.6kJ•mol-1②2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖期定律,计算298K时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的焓变+227.7kJ•mol-.(写出简要的计算过程).
2.已知:NaAlO2+NaHCO3+H2O═Na2CO3+Al(OH)3↓,向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
9.只用一种试剂就可将MgCl2、AlCl3、FeCl2、FeCl3、NH4Cl五种溶液区分开来,这种试剂是( )
| A. | 氨水 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | KSCN溶液 |
6.一种三室微生物燃料电池污水净化系统原理如图所示,图中废水中有机物可用C6H10O5表示.下列有关说法正确的是( )


| A. | b电极为该电池的负极 | |
| B. | b电极附近溶液的pH减小 | |
| C. | a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | a交换膜为阳离子交换膜 |
11.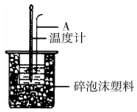 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-56.0kJ/mol
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是abc(填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ•mol-1.则CH3COOH在水溶液中电离的△H等于C
A.-67.7kJ•mol-1 B.-43.5kJ•mol-1C.+43.5kJ•mol-1 D.+67.7kJ•mol-1.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-56.0kJ/mol
 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ•mol-1.则CH3COOH在水溶液中电离的△H等于C
A.-67.7kJ•mol-1 B.-43.5kJ•mol-1C.+43.5kJ•mol-1 D.+67.7kJ•mol-1.