题目内容
8. 常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )
常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )| A. | HA为弱酸 | |
| B. | 常温下,MA溶液的pH>7 | |
| C. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| D. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH-)+c(A-) |
分析 0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒计算K点c(MOH)和c(M+)的和.
解答 解:A.0.01mol•L-1 HA溶液中pH=2,则HA是强酸,故A错误;
B.N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,常温下,MA溶液的pH<7,故B错误;
C.K点溶液呈碱性,得到的是等浓度的MOH和MA的混合物,此时存在c(M+)+c(MOH)=2c(A-),故C错误;
D.在N到K间任意一点对应的溶液中,一定都存在电荷守恒:c(M+)+c(H+)=c(OH-)+c(A-),故D正确;
故选D.
点评 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
18.下列离子方程式书写正确的是( )
| A. | Fe2O3固体中加入HI溶液:Fe2O3+6H+═2Fe3++3H2O | |
| B. | NaAlO2溶液和NaHCO3溶液混合:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| C. | 碳酸氢钙溶液中加入少量澄清石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | NaOH和Ba(OH)2混合溶液中通入少量CO2:2OH-+CO2═CO32-+H2O |
13.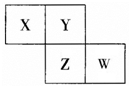 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )| A. | 氧化物对应水化物酸性W比Z强 | |
| B. | Y单质与Z的氢化物水溶液反应,有沉淀生成 | |
| C. | X单质氧化性强于Y单质 | |
| D. | 简单离子的半径:Z<W |
20.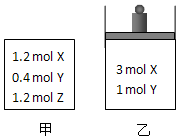 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( ) | 恒容容器甲 | 恒压容器乙 | |
| X的物质的量(mol) | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前小 | |
| B. | 平衡时容器甲的压强一定比反应前小 | |
| C. | n2>n1 | |
| D. | φ2<φ1 |
17.强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ/mol.已知:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(1);△H=-Q1kJ/mol
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(1);△H=-Q2kJ/mol
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1);△H=-Q3kJ/mol
则Q1、Q2、Q3的关系正确的是( )
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(1);△H=-Q1kJ/mol
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(1);△H=-Q2kJ/mol
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1);△H=-Q3kJ/mol
则Q1、Q2、Q3的关系正确的是( )
| A. | Q3>Q2>Q1 | B. | Q1>Q3>Q2 | C. | Q1=Q2=Q3 | D. | Q2>Q3>Q1 |
18.(1)A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol•L-1.反应进行2min后A的浓度为0.8mol•L-1,B的浓度为0.6mol•L-1,C的浓度为0.6mol•L-1.则2min内反应的平均速v(A)=0.1mol/(Lmin).
(2)反应A+3B═2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol•L-1•s-1
②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1
④v(D)=0.45mol•L-1•s-1.
该反应进行的快慢顺序为④>②=③>①
(3)如表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
?实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大 反应速率越快,能表明同一规律的实验还有1和2(填实验序号);?本实验中影响反应速率的其他因素还有反应温度,其实验序号是6和7、8和9.
(2)反应A+3B═2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol•L-1•s-1
②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1
④v(D)=0.45mol•L-1•s-1.
该反应进行的快慢顺序为④>②=③>①
(3)如表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
?实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大 反应速率越快,能表明同一规律的实验还有1和2(填实验序号);?本实验中影响反应速率的其他因素还有反应温度,其实验序号是6和7、8和9.
 亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答: