题目内容
20.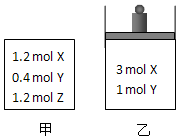 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( ) | 恒容容器甲 | 恒压容器乙 | |
| X的物质的量(mol) | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前小 | |
| B. | 平衡时容器甲的压强一定比反应前小 | |
| C. | n2>n1 | |
| D. | φ2<φ1 |
分析 将甲中Z极限转化为X、Y,起始量与乙中相同,固定恒容容器甲,则对乙来说,发生3X(g)+Y(g)?2Z(g),n偏小,V偏小,则相当于加压,乙中正向移动的程度大,以此来解答.
解答 解:将甲中Z完全转化为X和Y时,1.2molZ能转化为1.8molX、0.6molY,则X、Y的物质的量分别是3mol、1mol,所以与乙的初始状态是等效平衡,
该反应的正反应是一个反应前后气体体积减小的放热反应,甲恒容、乙恒压,乙在反应过程中与甲相比相当于增大压强,平衡正向移动,
A.乙中,温度和压强不变,容器中气体物质的量与体积成正比,平衡正向移动,气体的物质的量减小,则压强减小,所以平衡时容器乙的容积一定比反应前小,故A正确;
B.甲中,温度和条件不变,容器中气体压强与物质的量成正比,甲中反应向哪个方向移动还是平衡状态未知,所以无法确定气体物质的量任何变化,导致无法确定压强是否变化及如何变化,故B错误;
C.甲恒容、乙恒压,乙在反应过程中与甲相比相当于增大压强,平衡正向移动,反应物转化率增大,则Y的物质的量n2<n1,故C错误;
D.甲恒容、乙恒压,乙在反应过程中与甲相比相当于增大压强,平衡正向移动,生成物含量增大,所以φ2>φ1,故D错误;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握极限转化及等效平衡的判断为解答的关键,侧重分析与计算能力的考查,注意选项B为解答的难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.环境保护是公民的责任和义务.下列说法中正确的是( )
| A. | 大量使用含磷洗涤剂会引发潮汐 | |
| B. | 减少使用氟氯代烃的目的是减少酸雨 | |
| C. | 大量开采地下水,矿产资源,以满足社会经济发展的需求 | |
| D. | 氢燃料电池汽车的使用,可以有效减少城市空气污染 |
11.下列各组离子在指定环境中能大量共存的是( )
| A. | 在c(CO32-)=0.1 mol•L-1的溶液中:K+、AlO2-、Cl-、NO3- | |
| B. | 在常温下由水电离出的c(OH-)=1×10-12 mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | 在加入苯酚会显紫色的溶液中:NH4+、Cl-、Na+、SCN- | |
| D. | 在能使蓝色石蕊试纸变红的溶液中:S2O32-、CO32-、Na+、K+ |
8. 常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )
常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )
 常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )
常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )| A. | HA为弱酸 | |
| B. | 常温下,MA溶液的pH>7 | |
| C. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| D. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH-)+c(A-) |
15.下列有关CuSO4溶液的叙述正确的是( )
| A. | 通入CO2气体产生蓝色沉淀 | |
| B. | 该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 | |
| C. | 与H2S反应的离子方程式:Cu2++S2-=CuS↓ | |
| D. | 与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ |
12.2011年是国际化学年.中国的宣传口号是“化学--我们的生活.我们的未来”.下列有关叙不正确的是( )
| A. | 在家用燃煤中加人适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 利用太阳能、潮汐能、风力发电,以获取清洁能源 | |
| C. | 采用纳米二氧化钛光触媒技术.将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 大量排放SO2,NO2或CO2都会导致酸雨的形成 |
9.在反应Cl2+KOH(浓热)→KClO3+KCl+H2O中,氧化剂与还原剂物质的量之比为( )
| A. | 1:1 | B. | 4:1 | C. | 1:4 | D. | 5:1 |