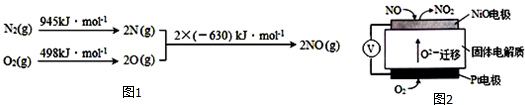题目内容
6.能正确表示下列反应的离子方程式是( )| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2═2NH4++SO32-+H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+═2Fe3++3H2O |
分析 A.用过量氨水吸收工业尾气中的SO2,二者反应生成亚硫酸铵;
B.浓盐酸和高锰酸钾反应生成氯气;
C.用Cu作电极时电解硫酸铜溶液,该装置是电镀池,阳极上Cu失电子发生氧化反应;
D.氧化铁和氢离子反应生成铁离子,铁离子和碘离子反应生成碘单质和亚铁离子.
解答 解:A.用过量氨水吸收工业尾气中的SO2,二者反应生成亚硫酸铵,离子方程式为2NH3•H20+SO2═2NH4++SO32-+H2O,故A正确;
B.浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故B错误;
C.用Cu作电极时电解硫酸铜溶液,该装置是电镀池,阳极上Cu失电子发生氧化反应,阳极反应式为Cu-2e-=Cu2+,阴极反应式为Cu2++2e-=Cu,故C错误;
D.氧化铁和氢离子反应生成铁离子,铁离子和碘离子反应生成碘单质和亚铁离子,离子方程式为Fe2O3+6H++2I-═2Fe2++3H2O+I2,故D错误;
故选A.
点评 本题考查离子方程式正误判断,为高频考点,明确离子方程式书写规则、物质性质是解本题关键,涉及氧化还原反应、复分解反应,易错选项是D,注意铁离子和碘离子发生的氧化还原反应,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
17.将新制氯水注入KI溶液中充分反应后,再加CCl4,振荡后静置,看到的现象是( )
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
1.(Ⅰ)在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol.回答下列问题:
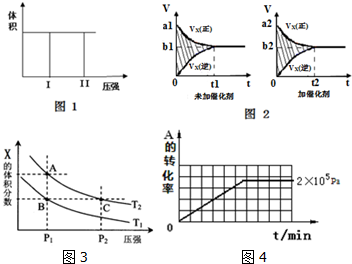
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
(Ⅱ)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡不移动(填:向左,向右,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:K=$\frac{c(C){\;}^{p}}{c(A){\;}^{m}}$.
(4)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).

(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
(Ⅱ)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:K=$\frac{c(C){\;}^{p}}{c(A){\;}^{m}}$.
(4)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).
18.平衡常数的大小可以表示反应进行的程度,平衡常数越大,说明( )
| A. | 反应物平衡浓度较大 | B. | 反应越有利于往逆反应方向进行 | ||
| C. | 反应进行的越彻底 | D. | 生成物平衡浓度较小 |
15.在25℃时,将两个铂电极插入一定量饱和Na2SO4溶液中进行电解,通电一段时间后,在阳极上放出ɑ mol气体,同时有w g Na2SO4•10H2O晶体析出.若温度不变,此时剩余溶液中溶质的质量分数为( )
| A. | $\frac{100w}{w+18a}$% | B. | $\frac{7100w}{161(w+18a)}$% | C. | $\frac{100w}{w+36a}$% | D. | $\frac{7100w}{161(w+36a)}$% |
16.将1mol一氧化碳和1mol水蒸气放入一固定容积的密闭容器中,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),在一定温度下,反应达到平衡后,得到0.6mol二氧化碳,再加入2mol水蒸气并在相同条件下达到新平衡后,下列叙述正确的是( )
| A. | 一氧化碳的转化率提高,水蒸气的转化率降低 | |
| B. | 反应物的转化率都提高 | |
| C. | 平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数增大 | |
| D. | 平衡向正反应方向移动,二氧化碳的物质的量将大于1 mol但小于2 mol |