题目内容
11.如图是一个化学过程的示意图.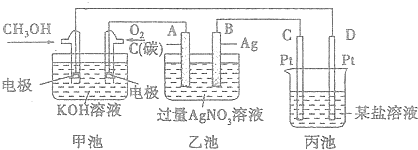
(1)图中甲池中OH-移向CH3OH极(填“CH3OH”或“O2”).
(2)写出通入CH3OH的电极的电极反应式:CH3OH-6e-+8OH-═CO32+6H2O.
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为A极(填“A”或“B”),并写出此电极的反应式:4OH--4e-═O2↑+2H2O.
(4)乙池中总反应的离子方程式:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+.
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是1(若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是BC(填序号).
A.MgS04 B.CuS04 C.AgN03 D.AlCl3.
分析 (1)燃料电池属于原电池,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(3)乙池有外接电源是电解池,阳极上氢氧根离子放电,阴极上银离子放电,酸性溶液使紫色石蕊试液变红,根据电极附近溶液的酸碱性变化确定溶液变红的电极;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,据此写出离子方程式;
(5)根据银和氢离子关系式计算氢离子浓度,从而确定溶液的pH,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素.
解答 解:(1)燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动,
故答案为:CH3OH;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上氢氧根离子放电导致电极附近氢离子浓度大于氢氧根离子浓度,溶液呈酸性,加热紫色石蕊试液呈红色,电极反应式为4OH--4e-=O2↑+2H2O,
故答案为:A,4OH--4e-=O2↑+2H2O;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+,
故答案为:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+;
(5)当乙池中B(Ag)极的质量增加5.40g时,设氢离子浓度为xmol/L,
4Ag++2H2O=4Ag+O2↑+4H+;
432g 4mol
5.40g 0.5xmol
解得:x=0.1,所以溶液的pH=1,
阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素,析出5.40g时转移电子是0.05mol,
A、硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;
B、电解硫酸铜溶液时,阴极上析出1.60g铜需要转移电子0.05mol,故正确;
C、电解硝酸银溶液时,阴极上析出1.60g银需要转移电子0.0148mol<0.05mol,故正确;
D、氯化铝中铝元素处于氢元素前,所以阴极上不析出金属单质,故错误;
故选BC;
故答案为:1;BC.
点评 本题考查了原电池和电解池原理的应用,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力,注意(5)题中,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,为易错点.

| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
| A. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Na2O2与H2O反应制备O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+3Cl2═2Fe3++Br2+6Cl- |
| A. | 向铜片中滴加浓硫酸并加热,有刺激性气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2═2 I2+2H2O | |
| D. | 服用阿司匹林过量出现水杨酸( )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: +2 HCO3-→ +2 HCO3-→ +2 CO2↑+2 H2O +2 CO2↑+2 H2O |
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2═2NH4++SO32-+H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+═2Fe3++3H2O |
| A. | 60% | B. | 33.3% | C. | 36% | D. | 40% |
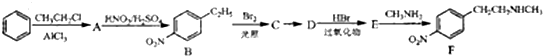
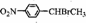 .
.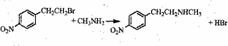 .
.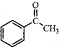 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线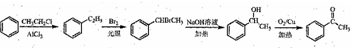 .
.