题目内容
16.将1mol一氧化碳和1mol水蒸气放入一固定容积的密闭容器中,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),在一定温度下,反应达到平衡后,得到0.6mol二氧化碳,再加入2mol水蒸气并在相同条件下达到新平衡后,下列叙述正确的是( )| A. | 一氧化碳的转化率提高,水蒸气的转化率降低 | |
| B. | 反应物的转化率都提高 | |
| C. | 平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数增大 | |
| D. | 平衡向正反应方向移动,二氧化碳的物质的量将大于1 mol但小于2 mol |
分析 反应CO(g)+H2O(g)?CO2(g)+H2(g),达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物,依此分析.
解答 解:根据题意:CO+H2O(g)?CO2 +H2,
初始物质的量:1 1 0 0
变化物质的量:0.6 0.6 0.6 0.6
平衡物质的量:0.4 0.4 0.6 0.6
此时二氧化碳和氢气的物质的量之和是1.2mol,平衡状态二氧化碳体积分数=$\frac{0.6mol}{0.4mol+0.4mmol+0.6mol+0.6mol}$×100%=30%,再通入2mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各0.4mol,此时CO2的物质的量1mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2的物质的量介于0.6mol-1mol之间,加入的水蒸气2mol 不能全部转化生成的二氧化碳;
A、加入2mol水蒸气,平衡向正反应方向移动,一氧化碳转化率增大,水的转化率减小,故A正确;
B、加入2mol水蒸气,平衡向正反应方向移动,一氧化碳转化率增大,水的转化率减小,故B错误;
C、加入2mmol水蒸气,平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数减小,故C错误;
D、平衡向正反应方向移动,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2的物质的量介于0.6mol-1mol之间,故D错误;
故选A.
点评 本题考查了化学平衡影响因素分析判断,题目难度中等,注意反应可逆反应特点之一是不能进行彻底,掌握可逆反应的特点和平衡移动是关键.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
6.能正确表示下列反应的离子方程式是( )
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2═2NH4++SO32-+H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+═2Fe3++3H2O |
7.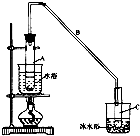 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料.
(1)实验室可由环己醇制备环己烯,反应的化学方程式是 .
.
(2)实验装置如下图所示,将10mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.环己醇和环己烯的部分物理性质如下:
①A中碎瓷片的作用是防止暴沸;导管B除了导气外还具有的作用是冷凝.
②试管A置于水浴中的目的是受热均匀,便于控温;
试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(3)环己烯粗品中含有少量环己醇和酸性杂质.精制环己烯的方法是:
①向环己烯粗品中加入C(填入编号),充分振荡后,分液(填操作名称).
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
②再对初步除杂后的环己烯进行蒸馏,得到环己烯精品.蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是除去产品中少量的水.
③实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象.
 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料.(1)实验室可由环己醇制备环己烯,反应的化学方程式是
 .
.(2)实验装置如下图所示,将10mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.环己醇和环己烯的部分物理性质如下:
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
②试管A置于水浴中的目的是受热均匀,便于控温;
试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(3)环己烯粗品中含有少量环己醇和酸性杂质.精制环己烯的方法是:
①向环己烯粗品中加入C(填入编号),充分振荡后,分液(填操作名称).
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
②再对初步除杂后的环己烯进行蒸馏,得到环己烯精品.蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是除去产品中少量的水.
③实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象.
4.现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+) |
11.用下列气体和液体不能进行喷泉实验的是( )
| A. | CO2和NaOH溶液 | B. | SO2和稀氨水 | C. | NO2和NaOH溶液 | D. | Cl2和饱和食盐水 |
8.取38.4g铜与适量的浓硝酸反应,铜全部反应后,共收集到22.4L(标准状况)气体,反应消耗HNO3的物质的量可能是( )
| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
5.80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s-40s内用N2O4表示的平均反应速率为0.0020 mol•L-1•s-1
(2)计算在80℃时该反应的平衡常数K=1.8mol•L-1;
(3)要增大该反应的K值,可采取的措施有(填序号)D
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度.
| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=1.8mol•L-1;
(3)要增大该反应的K值,可采取的措施有(填序号)D
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度.