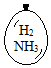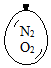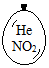题目内容
17.X、Y、Z、W、Q五种短周期元素在元素周期表中的位置如表所示,其中X元素原子的最外层电子数是最内层电子数的3倍,则下列说法一定正确的是( )| X | Y | |
| Z | W | Q |
| A. | X、W能分别与钠形成摩尔质量相同且阴、阳离子个数比为1:2的化合物 | |
| B. | X和Z只能形成一种化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
分析 X、Y、Z、W、Q五种短周期元素,其中X元素原子的最外层电子数是最内层电子数的3倍,则X为O元素,结合元素在周期表中的位置可知,Z为P,W为S,Y为F,Q为Cl,以此来解答.
解答 解:由上述分析可知,X为O,Z为P,W为S,Y为F,Q为Cl,
A.X、W能分别与钠形成摩尔质量相同且阴、阳离子个数比为1:2的化合物,分别为Na2O2、Na2S,故A正确;
B.X和Z能形成多种化合物,如P2O3、P2O5,故B错误;
C.非金属性Cl>S,最高价氧化物对应的水化物酸性:W<Q,故C错误;
D.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径大小关系:Z>W>Q>Y,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
8.相同状况下,1.12L乙烷和丁烷的混合物完全燃烧需O2 4.76L,则混合气中乙烷的体积分数是( )
| A. | 25% | B. | 35% | C. | 65% | D. | 75% |
5.下列实验操作和现象,得出的结论正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用湿润的蓝色石蕊试纸检验某气体 | 试纸变红 | 气体呈碱性 |
| B | 铁粉中加入新制氯水,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 铁粉被氧化成Fe3+ |
| C | 向Mg(OH)2的上层清液中滴加MgCl2溶液 | 沉淀变成白色 | Qc[Mg(OH)2]<Ksp[Mg(OH)2] |
| D | 将少量溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CC14,振荡静置 | 下层分别为无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
12. 已知反应:2NO2(红棕色)?N2O4(无色)△H<O.将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(红棕色)?N2O4(无色)△H<O.将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小).下列说法不正确的是( )
 已知反应:2NO2(红棕色)?N2O4(无色)△H<O.将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(红棕色)?N2O4(无色)△H<O.将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小).下列说法不正确的是( )| A. | b点达到平衡状态 | |
| B. | b点与a点相比,c(NO2)、c(N2O4)均减小 | |
| C. | d点:v(正)<v(逆) | |
| D. | 若在c点将温度降低,其透光率将增大 |
2.下列有关化学用语的表示中正确的是( )
| A. | CO2的电子式: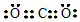 | B. | 聚丙烯的结构简式: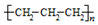 | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | D. | 镁离子的结构示意图: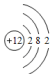 |
9.化学与社会、生活密切相关,下列说法正确的是( )
| A. | 纤维素在人体内可水解为葡萄糖,故可用作人体的营养物质 | |
| B. | 明矾水解时能生成具有吸附性的胶体粒子,故可用作漂白剂 | |
| C. | Ba2+对人体无毒,故BaSO4在医学上可用作钡餐 | |
| D. | MgO熔点很高,故可用作耐高温材料 |
6.Na+的浓度不是1mol/L的溶液是( )
| A. | 0.5mol/L的NaCl | B. | 0.5 mol/L的Na2SO4 | ||
| C. | 1mol/L的NaOH | D. | 0.5 mol/L的Na2CO3 |
11.25℃时,有pH=4的稀盐酸、氯化铵两种溶液和pH=10的氢氧化钠、碳酸钠两种溶液,设四种溶液中水的电离度依次为α1、α2、α3、α4.下列说法正确的是( )
| A. | α1=α2<α3=α4 | B. | α1=α3<α2=α4 | C. | α1>α2>α3>α4 | D. | α1=α4>α2=α3 |
 在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )
在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )