题目内容
标准状况下,某气态烷烃和烯烃的混合气体2.24L,完全燃烧后生成4.05g水和6.6gCO2,该烃的组成为( )
| A、CH4、C3H6 |
| B、CH4、C2H4 |
| C、C2H4、C3H8 |
| D、C2H6、C3H6 |
考点:有关混合物反应的计算,有机物实验式和分子式的确定
专题:
分析:根据n=
计算4.05g水和6.6gCO2的物质的量,根据n=
计算混合烃的物质的量,然后根据H原子、C原子守恒计算混合物的平均分子组成,最后对各选项进行判断.
| m |
| M |
| V |
| Vm |
解答:
解:标准状况下2.24L混合烃的物质的量为:n=
=0.1mol,
4.05g水的物质的量为:n(H2O)=
=0.225mol,平均分子式中含有的H原子数目为:
=4.5,
6.6gCO2的物质的量为:n=
=0.15mol,平均分子式中含有的C原子数目为:
=1.5,
则该混合烃的平均分子式为:C1.5H4.5,
根据平均C原子数可知,烃中碳原子数小于1的只有甲烷,则该烃中一定含有CH4,故C、D错误;
甲烷分子中含有4个H原子,而平均分子式中H原子数为4.5,另一烃的分子中H原子数目大于4,故A正确、B错误,
故选A.
| 2.24L |
| 22.4L/mol |
4.05g水的物质的量为:n(H2O)=
| 4.05g |
| 18g/mol |
| 0.225mol×2 |
| 0.1mol |
6.6gCO2的物质的量为:n=
| 6.6g |
| 44g/mol |
| 0.15mol |
| 0.1mol |
则该混合烃的平均分子式为:C1.5H4.5,
根据平均C原子数可知,烃中碳原子数小于1的只有甲烷,则该烃中一定含有CH4,故C、D错误;
甲烷分子中含有4个H原子,而平均分子式中H原子数为4.5,另一烃的分子中H原子数目大于4,故A正确、B错误,
故选A.
点评:本题考查有机物分子的判断,题目难度中等,解题关键是掌握利用平均分子组成判断烃的组成的方法,常用方法有:平均碳法、平均氢法、平均碳氢分子式法、平均式量法.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列所示装置中的实验能达到目的是( )
A、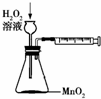 用以定量测定化学反应速率 |
B、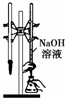 为用已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
C、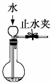 可以检查装置的气密性 |
D、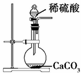 为实验室制取少量CO2的发生装置 |
利用下列实验装置进行的相应实验,不能达到实验目的是( )
A、 可制取氨气 |
B、 可分离CH3CH2OH和CH3COOC2H5混合液 |
C、 可制备Fe(OH)2并容易观察到白色沉淀 |
D、 可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂自性、还原性 |
关于下列各实验装置的叙述中,不正确的是( )


| A、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| B、装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C、装置①可用于分离乙醇和水的混合物 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
饱和氯水中存在如下平衡:①Cl2+H2O═H++Cl-+HClO;②HClO═H++ClO-,将饱和氯水倒入试管中分别进行下列实验,相应分析结论错误的是( )
| A、加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 |
| B、加入澄清石灰水,c(H+)一定减小 |
| C、加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
| D、通入过量Cl2,①、②均向右移动,溶液pH减小 |
图是某燃煤发电厂处理废气的装置示意图,下列说法不正确的是( )


| A、使用此装置可减少导致酸雨的气体形成 |
| B、装置内发生了化合反应和分解反应 |
| C、整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2 |
| D、若排放的气体能使澄清石灰水变浑浊,说明排放的气体中含SO2 |
 已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.
已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.