题目内容
利用下列实验装置进行的相应实验,不能达到实验目的是( )
A、 可制取氨气 |
B、 可分离CH3CH2OH和CH3COOC2H5混合液 |
C、 可制备Fe(OH)2并容易观察到白色沉淀 |
D、 可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂自性、还原性 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.生石灰与水反应放热,可促进氨气挥发;
B.CH3CH2OH和CH3COOC2H5混溶,溶液不分层;
C.为防止Fe(OH)2被氧化,可加入没有隔绝空气;
D.浓硫酸和蔗糖反应生成二氧化硫,二氧化硫可使品红褪色,与高锰酸钾发生氧化还原反应.
B.CH3CH2OH和CH3COOC2H5混溶,溶液不分层;
C.为防止Fe(OH)2被氧化,可加入没有隔绝空气;
D.浓硫酸和蔗糖反应生成二氧化硫,二氧化硫可使品红褪色,与高锰酸钾发生氧化还原反应.
解答:
解:A.生石灰与水反应放热,可促进氨气挥发,可用于实验室制备少量氨气,故A正确;
B.CH3CH2OH和CH3COOC2H5混溶,溶液不分层,应用蒸馏的方法分离,故B错误;
C.为防止Fe(OH)2被氧化,可加入没有隔绝空气,故C正确;
D.浓硫酸和蔗糖反应,蔗糖变黑,说明浓硫酸具有脱水性,生成二氧化硫,二氧化硫可使品红褪色,与高锰酸钾发生氧化还原反应,故D正确.
故选B.
B.CH3CH2OH和CH3COOC2H5混溶,溶液不分层,应用蒸馏的方法分离,故B错误;
C.为防止Fe(OH)2被氧化,可加入没有隔绝空气,故C正确;
D.浓硫酸和蔗糖反应,蔗糖变黑,说明浓硫酸具有脱水性,生成二氧化硫,二氧化硫可使品红褪色,与高锰酸钾发生氧化还原反应,故D正确.
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及常见物质的制备、氧化还原反应、性质实验及实验基本技能等,把握物质的性质、化学反应原理为解答的关键,侧重性质与原理的考查,注意实验的可行性、评价性分析,题目难度不大.

练习册系列答案
相关题目
14 6 |
14 6 |
| A、中子数为14 | ||
| B、质子数为14 | ||
| C、核外电子数为14 | ||
D、
|
标准状况下,某气态烷烃和烯烃的混合气体2.24L,完全燃烧后生成4.05g水和6.6gCO2,该烃的组成为( )
| A、CH4、C3H6 |
| B、CH4、C2H4 |
| C、C2H4、C3H8 |
| D、C2H6、C3H6 |
关于下列装置图的叙述正确的是( )
A、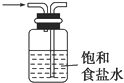 是洗气装置,除去氯气中的氯化氢 |
B、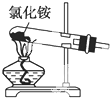 制取氨气 |
C、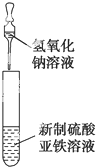 可用于制备氢氧化亚铁并观察其颜色 |
D、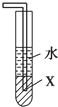 中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
某小组利用下列装置进行电化学实验,盐桥中填充琼脂及饱和KNO3溶液,下列说法正确的是( )
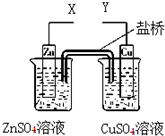

A、若X和Y与电流表 连接,则电流方向:锌电极→ 连接,则电流方向:锌电极→ →铜电极 →铜电极 |
B、若X和Y与电流表 连接,盐桥中的K+向左边烧杯移动 连接,盐桥中的K+向左边烧杯移动 |
| C、若X和Y分别与电源“-”、“+”极相连,Cu极发生氧化反应 |
| D、若X和Y分别与电源“-”、“+”极相连,Zn极质量减轻 |
在实验室进行下列实验,括号内的实验仪器或试剂都能用到的是( )
| A、中和热的测定(量筒、温度计、酒精灯) |
| B、从溴水中提取溴单质(分液漏斗、无水乙醇、玻璃棒) |
| C、探究浓硫酸与铜反应的产物(蘸有碳酸钠溶液的棉花团、蒸馏水、烧杯) |
| D、制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管) |
 A
A