题目内容
下列所示装置中的实验能达到目的是( )
A、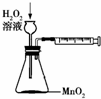 用以定量测定化学反应速率 |
B、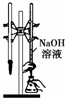 为用已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
C、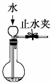 可以检查装置的气密性 |
D、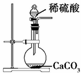 为实验室制取少量CO2的发生装置 |
考点:化学实验方案的评价
专题:
分析:A.生成氧气可能从长颈漏斗逸出;
B.NaOH应装在碱式滴定管;
C.关闭止水夹,利用液面差检验气密性;
D.生成硫酸钙微溶,阻止反应进一步进行.
B.NaOH应装在碱式滴定管;
C.关闭止水夹,利用液面差检验气密性;
D.生成硫酸钙微溶,阻止反应进一步进行.
解答:
解:A.开始反应后,气体会从长颈漏斗中逸出,不能测定气体的体积,故A错误;
B.NaOH溶液应盛装在碱式滴定管中,图中仪器的使用不合理,故B错误;
C.关闭止水夹,从长颈漏斗注入水,观察液面差可检验装置的气密性,故C正确;
D.实验室制取CO2所用的是稀盐酸而不是稀硫酸,因为硫酸与CaCO3反应生成的CaSO4难溶,难溶的CaSO4覆盖在CaCO3表面,会阻止反应继续进行,故D错误;
故选C.
B.NaOH溶液应盛装在碱式滴定管中,图中仪器的使用不合理,故B错误;
C.关闭止水夹,从长颈漏斗注入水,观察液面差可检验装置的气密性,故C正确;
D.实验室制取CO2所用的是稀盐酸而不是稀硫酸,因为硫酸与CaCO3反应生成的CaSO4难溶,难溶的CaSO4覆盖在CaCO3表面,会阻止反应继续进行,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及反应速率测定、中和滴定、气密性检查、气体的制备实验等,把握物质的性质、反应原理为解答的关键,侧重基本实验操作和实验分析的考查,意在考查考生的实验操作和分析能力,注意实验的可行性、评价性分析,题目难度不大.

练习册系列答案
相关题目
下列离子或分子能够在指定的分散系中大量共存的是( )
| A、c(H+)=10-13mol/L的溶液中:NO3-、SO42-、K+、Na+ |
| B、澄清石灰水中:Na+、K+、CH3COO -、HCO3- |
| C、铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- |
| D、空气中:SO2、NO、N2、NH3 |
下列贮存化学试剂的方法不正确的是( )
| A、浓硝酸保存在棕色试剂瓶中 |
| B、金属钠通常保存在煤油里,不能保存在四氯化碳中 |
| C、烧碱溶液保存在带玻璃塞的磨口试剂瓶中 |
| D、配置一定物质的量浓度的氯化钠溶液时,要将氯化钠固体放在滤纸上称量 |
标准状况下,某气态烷烃和烯烃的混合气体2.24L,完全燃烧后生成4.05g水和6.6gCO2,该烃的组成为( )
| A、CH4、C3H6 |
| B、CH4、C2H4 |
| C、C2H4、C3H8 |
| D、C2H6、C3H6 |
一定条件下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al | 稀硫酸 |
| ② | KOH溶液 | Br2 | Na2SO3溶液 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、只有①③④ |
| B、只有①②④ |
| C、只有①②③ |
| D、①②③④皆可 |
 工、农业废水以及生活污水中浓度较高的NO3-会造成氮污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水以及生活污水中浓度较高的NO3-会造成氮污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.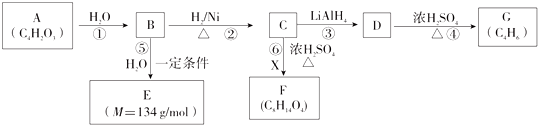
 A
A