题目内容
饱和氯水中存在如下平衡:①Cl2+H2O═H++Cl-+HClO;②HClO═H++ClO-,将饱和氯水倒入试管中分别进行下列实验,相应分析结论错误的是( )
| A、加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 |
| B、加入澄清石灰水,c(H+)一定减小 |
| C、加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
| D、通入过量Cl2,①、②均向右移动,溶液pH减小 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、加入CaCO3悬浊液,存在CaCO3(s)?Ca2+(aq)+CO32-(aq),氯水中的氢离子与碳酸根离子反应,碳酸根离子浓度减小;
B、加入澄清石灰水,与氢离子反应发生中和反应,导致c(H+)减小;
C、加入一定量NaOH溶液后,如果溶液呈中性,则有c(Cl-)+c(ClO-)=c(Na+);
D、因为是饱和氯水,再通入氯气不溶解,平衡不移动,溶液的PH不变.
B、加入澄清石灰水,与氢离子反应发生中和反应,导致c(H+)减小;
C、加入一定量NaOH溶液后,如果溶液呈中性,则有c(Cl-)+c(ClO-)=c(Na+);
D、因为是饱和氯水,再通入氯气不溶解,平衡不移动,溶液的PH不变.
解答:
解:A、加入CaCO3悬浊液,存在CaCO3(s)?Ca2+(aq)+CO32-(aq),氯水中的氢离子与碳酸根离子反应,碳酸根离子浓度减小,溶解平衡向右移动,故A正确;
B、加入澄清石灰水,与氢离子反应,导致c(H+)减小,故B正确;
C、加入一定量NaOH溶液后,如果溶液呈中性,结合电荷守恒,则有c(Cl-)+c(ClO-)=c(Na+),故C正确;
D、因为是饱和氯水,再通入氯气不溶解,平衡不移动,溶液的PH不变,故D错误;
故选D.
B、加入澄清石灰水,与氢离子反应,导致c(H+)减小,故B正确;
C、加入一定量NaOH溶液后,如果溶液呈中性,结合电荷守恒,则有c(Cl-)+c(ClO-)=c(Na+),故C正确;
D、因为是饱和氯水,再通入氯气不溶解,平衡不移动,溶液的PH不变,故D错误;
故选D.
点评:本题考查弱电解质在水中的电离和电离平衡的移动,学生只要掌握平衡移动的原理,就可以迅速解题了,比较容易.

练习册系列答案
相关题目
标准状况下,某气态烷烃和烯烃的混合气体2.24L,完全燃烧后生成4.05g水和6.6gCO2,该烃的组成为( )
| A、CH4、C3H6 |
| B、CH4、C2H4 |
| C、C2H4、C3H8 |
| D、C2H6、C3H6 |
某小组利用下列装置进行电化学实验,盐桥中填充琼脂及饱和KNO3溶液,下列说法正确的是( )
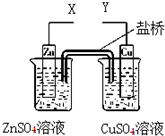

A、若X和Y与电流表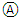 连接,则电流方向:锌电极→ 连接,则电流方向:锌电极→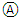 →铜电极 →铜电极 |
B、若X和Y与电流表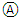 连接,盐桥中的K+向左边烧杯移动 连接,盐桥中的K+向左边烧杯移动 |
| C、若X和Y分别与电源“-”、“+”极相连,Cu极发生氧化反应 |
| D、若X和Y分别与电源“-”、“+”极相连,Zn极质量减轻 |
一定条件下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al | 稀硫酸 |
| ② | KOH溶液 | Br2 | Na2SO3溶液 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、只有①③④ |
| B、只有①②④ |
| C、只有①②③ |
| D、①②③④皆可 |
下列说法正确的是( )
| A、向蒸馏水中滴加浓H2SO4时,KW不变 |
| B、常温下,0.005mol?L-1Ba(OH)2溶液pH为12 |
| C、NaHCO3水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ |
| D、NaHSO3属于强碱弱酸盐,其水溶液一定显碱性 |
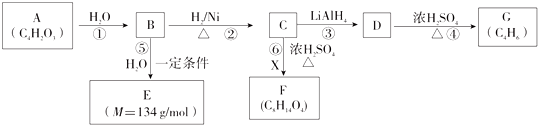
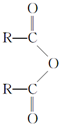
 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示: