题目内容
6.将质量为1.15g钠用刺了孔的铝箔包裹后放入水中,反应结束后共收集到0.055mol气体.请回答下列问题,写出必要的计算过程:(1)1.15g钠与水反应,理论上生成气体的体积(标准状况)为多少?
(2)若反应后溶液的体积为50ml,则反应后氢氧化钠溶液的浓度为多少?
分析 (1)发生反应:2Na+2H2O=2NaOH+H2↑,根据方程式中对比关系计算生成氢气体积;
(2)氢气的总体积减去钠与水反应生成氢气的体积就是铝与氢氧化钠反应生成的氢气体积,根据方程式恒计算NaAlO2物质的量、Al反应消耗NaOH物质的量,进而计算溶液中NaOH的物质的量浓度.
解答 解:(1)设生成氢气的体积为V,则:
2Na+2H2O=2NaOH+H2↑
46g 22.4L
1.15g V
V=$\frac{22.4L×1.15g}{46g}$=0.56L
故答案为:0.56L;
(2)1.15g Na的物质的量为$\frac{1.15g}{23g/mol}$=0.05mol,
Na反应生成氢气物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,
则Al反应生成氢气为0.055mol-0.025mol=0.03mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol 3mol
0.02 0.02mol 0.03mol
所以剩余氢氧化钠0.05mol-0.02mo=0.03mol,故氢氧化钠的物质的量浓度=$\frac{0.03mol}{0.05L}$=0.6mol/L
答:混合溶液中NaOH的物质的量浓度为0.6mol/L.
点评 本题考查混合物有关计算,注意氢气来源于钠与水反应及铝和氢氧化钠反应,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列叙述正确的是( )
| A. | 标准状况下,1mol H2O的体积约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 20℃、101 kPa时1mol HCl所占的体积约为22.4 L | |
| D. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L |
14.表是前20号元素中的部分元素的一些数据:
试回答下列问题:
(1)以上10种元素电负性最大的是O(填元素符号).比元素B原子序数大7的元素在元素周期表中的位置:第4周期,第VIII族,其基态原子的核外电子排布式是1s22s22p63s23p63d64s2(或[Ar]3d64s2).
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)N2<Na<Si.
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成7个σ键,1个π键.
(4)I与氢元素形成的10电子分子X的空间构型为三角锥形;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为[Cu(NH3)4]2+,其中X与Cu2+之间以配位键结合.
(5)如图1是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a.HNO3是极性分子,易溶于极性的水中
b.HNO3分子中的-OH易与水分子之间形成氢键
(6)如图2是J和E组成的晶体结构,则每个与J周围最近J原子数目为12,若晶胞边长为a cm,则晶体的密度为(用含a、NA的代数式表示)$\frac{4×M(SiC)}{{a}^{3}{N}_{A}}$或$\frac{4×40}{{a}^{3}{N}_{A}}$或$\frac{160}{{a}^{3}{N}_{A}}$(g/mL)

| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素电负性最大的是O(填元素符号).比元素B原子序数大7的元素在元素周期表中的位置:第4周期,第VIII族,其基态原子的核外电子排布式是1s22s22p63s23p63d64s2(或[Ar]3d64s2).
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)N2<Na<Si.
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成7个σ键,1个π键.
(4)I与氢元素形成的10电子分子X的空间构型为三角锥形;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为[Cu(NH3)4]2+,其中X与Cu2+之间以配位键结合.
(5)如图1是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a.HNO3是极性分子,易溶于极性的水中
b.HNO3分子中的-OH易与水分子之间形成氢键
(6)如图2是J和E组成的晶体结构,则每个与J周围最近J原子数目为12,若晶胞边长为a cm,则晶体的密度为(用含a、NA的代数式表示)$\frac{4×M(SiC)}{{a}^{3}{N}_{A}}$或$\frac{4×40}{{a}^{3}{N}_{A}}$或$\frac{160}{{a}^{3}{N}_{A}}$(g/mL)


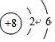 ;氮元素通常转化为化肥铵盐,铵根离子的电子式为
;氮元素通常转化为化肥铵盐,铵根离子的电子式为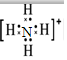 .
.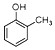 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )