题目内容
17.能大量共存于同一溶液中,且当水电离c(H+)=10-13mol/L时,又能发生反应的离子组是( )①Na+、Ba2+、C1-、HCO3-
②K+、NH4+、CH3COO-、SO42-
③Ca2+、NH4+、SO42-、SO32-
④Fe3+、Na+、SCN-、C1-
⑤A13+、Na+、HCO3-、NO3-.
| A. | 只有① | B. | ②③ | C. | ①④ | D. | ①② |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子、相互促进水解等,则离子大量共存,并结合当水电离c(H+)=10-13mol/L时(为酸或碱溶液),又能发生反应来解答.
解答 解:①该组离子之间不反应,可大量共存,碱溶液中反应生成碳酸钡沉淀,酸溶液中生成二氧化碳气体,故选;
②组离子之间不反应,可大量共存,碱溶液中反应生成一水合氨,酸溶液中生成醋酸,故选;
③Ca2+分别与SO42-、SO32- 结合生成沉淀,不能共存,故不选;
④Fe3+、SCN-结合生成络离子,不能共存,故不选;
⑤A13+、HCO3-相互促进水解,不能共存,故不选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解反应的判断,题目难度不大.

练习册系列答案
相关题目
7.金属钠与下列溶液反应时,既有白色沉淀析出又有气体逸出的是( )
| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | FeCl3溶液 | D. | Ca(HCO3)2溶液 |
5.把100mL 0.3mol•L-1的硫酸溶液和50mL 0.6mol•L-1的硫酸溶液充分混合后,该溶液中H+的物质的量浓度为( )
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
7.下列说法正确的是( )
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 可逆反应进行的程度是不可改变的 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 能自发进行的化学反应,一定是△H<0、△S>0 |
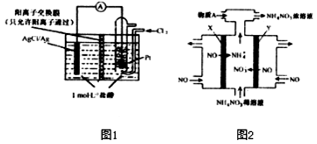 氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
氧化还原反应与生产、生活、科技密切相关,请回答下列问题: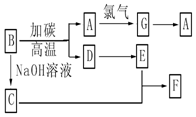 请回答下列问题:
请回答下列问题: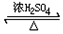 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.