��Ŀ����
 ��ʯȼ�Ͽ��ɺͼӹ������г��������������ҵ�Ͽ���������ȡ������������ѧ��������Һ�������ӷ����Լ���
��ʯȼ�Ͽ��ɺͼӹ������г��������������ҵ�Ͽ���������ȡ������������ѧ��������Һ�������ӷ����Լ�����1��H2S�ĵ���ʽΪ
��2������H2S������ȡ�����ij��������и����ȷֽⷨ�͵绯ѧ�����֣�
�ٸ����ȷֽⷨ��ԭ���ɱ�ʾΪ��H2S��g��?H2��g��+
| 1 |
| 2 |
a������ b������ c����ѹ d������
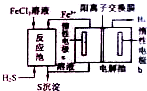
�ڵ绯ѧ��������̵�ʾ��ͼ��ͼ����Ӧ���з�����Ӧ�Ļ�ѧ����ʽΪ
��3��25��ʱ��H2S���������볣������ΪK+1=0.9��10-7��K+2=1.2��10-15���ں�Ũ�Ⱦ�Ϊ0.1mol?L-1��Fe2+��Cu2+��Pb2+��Mn2+�������ӵ���Һ�У�����c��H+��=0.3mol?L-1������0.1mol?L-1 H2S��Һ���ܱ�������������
���㣺��ѧƽ���Ӱ������,���������ˮ��Һ�еĵ���ƽ��,���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���,���ԭ��
ר�⣺�����������������
��������1��H2SΪ���ۻ������ԭ�����������8�����Ӵﵽ�ȶ��ṹ�������д�������H-S����
��2��������ƽ�ⳣ��������д����ʽ����������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻������ŷ�Ӧ�¶ȵ����ߣ�Kֵ������˵����Ӧ�����ȷ�Ӧ���Ѿ�Ӱ�컯ѧƽ��ͷ�Ӧ���ʵ����ط����ж�ѡ�
�ڷ�Ӧ���з�Ӧ��������������Һ������ʽ��������Ӧ��Ӵ��������Ӧ���з���������ԭ��Ӧ���Ȼ�����������Ϊ���ʣ��Ȼ��������Ȼ��⣻��������������ʧȥ���ӣ������ӵõ����ӣ�aΪ������������ʧ�������������ӣ�bΪ��������Һ�������ӵõ����������������Դ������
��3������c��H+��=0.3mol?L-1�����ݵ��볣������������Ũ�ȣ�����ܶȻ�������Ũ���̱ȽϷ����Ƿ������
��2��������ƽ�ⳣ��������д����ʽ����������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻������ŷ�Ӧ�¶ȵ����ߣ�Kֵ������˵����Ӧ�����ȷ�Ӧ���Ѿ�Ӱ�컯ѧƽ��ͷ�Ӧ���ʵ����ط����ж�ѡ�
�ڷ�Ӧ���з�Ӧ��������������Һ������ʽ��������Ӧ��Ӵ��������Ӧ���з���������ԭ��Ӧ���Ȼ�����������Ϊ���ʣ��Ȼ��������Ȼ��⣻��������������ʧȥ���ӣ������ӵõ����ӣ�aΪ������������ʧ�������������ӣ�bΪ��������Һ�������ӵõ����������������Դ������
��3������c��H+��=0.3mol?L-1�����ݵ��볣������������Ũ�ȣ�����ܶȻ�������Ũ���̱ȽϷ����Ƿ������
���
�⣺��1��H2SΪ���ۻ������ԭ�����������8�����Ӵﵽ�ȶ��ṹ�������д�������H-S��������ʽΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2����H2S��g��?H2��g��+
S2��g�����÷�Ӧ��ƽ�ⳣ������ΪK=
��ʵ��������ŷ�Ӧ�¶ȵ����ߣ�Kֵ������ӦΪ���ȷ�Ӧ��������߷ֽ����ʣ��������H2S��ƽ��ת���ʵ�Ӧ�øı���������Ӧ���ʣ�ƽ��������У�
a����Ӧ�����ȷ�Ӧ������ƽ��������У���Ӧ������������ת��������a���ϣ�
b����Ӧ�����ȷ�Ӧ������ƽ��������У���Ӧ���ʼ�С����b�����ϣ�
c����Ӧ�������������ķ�Ӧ����ѹ��Ӧ��������ƽ��������У�����ת���ʼ�С����c�����ϣ�
d�������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬����ת���ʲ��䣬��d�����ϣ�
�ʴ�Ϊ��
��a��
�ڷ�Ӧ���з�Ӧ��������������Һ������ʽ��������Ӧ��Ӵ��������Ӧ���з���������ԭ��Ӧ���Ȼ�����������Ϊ���ʣ���Ӧ�Ļ�ѧ����ʽΪ��H2S+2FeCl3=2FeCl2+S��+2HCl���Ȼ��������Ȼ��⣻��������������ʧȥ���ӣ������ӵõ����ӣ�aΪ������������ʧ�������������ӣ��缫��ӦΪ��Fe2+-e-=Fe3+��bΪ��������Һ�������ӵõ���������������
�ʴ�Ϊ��H2S+2FeCl3=2FeCl2+S��+2HCl��Fe2+-e-=Fe3+��
��3��25��ʱ��H2S���������볣������ΪK1=0.9��10-7��K2=1.2��10-15���ں�Ũ�Ⱦ�Ϊ0.1mol?L-1��Fe2+��Cu2+��Pb2+��Mn2+�������ӵ���Һ�У�����c��H+��=0.3mol?L-1������0.1mol?L-1 H2S��Һ��K1=0.9��10-7��K2=1.2��10-15������c��H+��=0.3mol?L-1��H2S?H++HS-��HS-?H++S2-��K1��K2=
��c��S2-��=
=1.2��10-22���ں�Ũ�Ⱦ�Ϊ0.1mol?L-1��Fe2+��Cu2+��Pb2+��Mn2+�������ӵ���Һ�У���֪Ksp��FeS��=6.3��10-18��Ksp��CuS��=1.3��10-36��Ksp��PbS��=3.4��10-28��Ksp��MnS��=2.5��10-13����c��Fe2+��c��S2-��=0.1��1.2��10-22=1.2��10-23��Ksp��FeS�����������Ӳ��ܳ�����
c��Cu2+��c��S2-��=0.1��1.2��10-22=1.2��10-23��1.3��10-36��ͭ���ӳ������м��αȽϿ�֪��Pb2+���ӳ�����Mn2+���ܳ�����
�ʴ�Ϊ��Cu2+��Pb2+��
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����2����H2S��g��?H2��g��+
| 1 |
| 2 |
c(H2)c
| ||
| c(H2S) |
a����Ӧ�����ȷ�Ӧ������ƽ��������У���Ӧ������������ת��������a���ϣ�
b����Ӧ�����ȷ�Ӧ������ƽ��������У���Ӧ���ʼ�С����b�����ϣ�
c����Ӧ�������������ķ�Ӧ����ѹ��Ӧ��������ƽ��������У�����ת���ʼ�С����c�����ϣ�
d�������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬����ת���ʲ��䣬��d�����ϣ�
�ʴ�Ϊ��
c(H2)c
| ||
| c(H2S) |
�ڷ�Ӧ���з�Ӧ��������������Һ������ʽ��������Ӧ��Ӵ��������Ӧ���з���������ԭ��Ӧ���Ȼ�����������Ϊ���ʣ���Ӧ�Ļ�ѧ����ʽΪ��H2S+2FeCl3=2FeCl2+S��+2HCl���Ȼ��������Ȼ��⣻��������������ʧȥ���ӣ������ӵõ����ӣ�aΪ������������ʧ�������������ӣ��缫��ӦΪ��Fe2+-e-=Fe3+��bΪ��������Һ�������ӵõ���������������
�ʴ�Ϊ��H2S+2FeCl3=2FeCl2+S��+2HCl��Fe2+-e-=Fe3+��
��3��25��ʱ��H2S���������볣������ΪK1=0.9��10-7��K2=1.2��10-15���ں�Ũ�Ⱦ�Ϊ0.1mol?L-1��Fe2+��Cu2+��Pb2+��Mn2+�������ӵ���Һ�У�����c��H+��=0.3mol?L-1������0.1mol?L-1 H2S��Һ��K1=0.9��10-7��K2=1.2��10-15������c��H+��=0.3mol?L-1��H2S?H++HS-��HS-?H++S2-��K1��K2=
| c2(H+)c(S2-) |
| c(H2S) |
| 1.2��10-15��0.9��10-7��0.1 |
| 0��32 |
c��Cu2+��c��S2-��=0.1��1.2��10-22=1.2��10-23��1.3��10-36��ͭ���ӳ������м��αȽϿ�֪��Pb2+���ӳ�����Mn2+���ܳ�����
�ʴ�Ϊ��Cu2+��Pb2+��
���������⿼���˻�ѧƽ��Ӱ�����أ�ƽ�ⳣ��������������ԭ���������������еļ���Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
��ѧ����ᡢ����������أ������й�˵������ȷ���ǣ�������
| A�����������Դ���滯ʯȼ�ϣ������ڽ�Լ��Դ���������� |
| B��ʳƷ���Ӽ��������ƣ����DZ���һ��ͬϵ������Ӧ������ |
| C������ҩ������ܶ࣬��̼�����ơ�̼��ơ�̼��þ�������������� |
| D���Ҵ����ڿ�������Դ |
�����й�˵����ȷ���ǣ�������
| A�������£���ӦCaCO3��s���TCaO��s��+CO2��g�������Է����У�˵���÷�Ӧ�ġ�H��0����S��0 |
| B������ʯ��ˮ�м�������CaO���ָ������º���Һ��pH���� |
| C��Na2CO3��Һ��ˮϡ�ͺָ���ԭ�¶ȣ���ҺpH��Kw����С |
| D����0��l mol?L-1��ϡ�����ˮϡ�͵Ĺ����У�c��H+����c��SO42-��ʼ��Ϊ2��1 |
�����ǹ�ҵ���Ʊ��Ա����ӵ������ϳ���·���й�˵����ȷ���ǣ�������
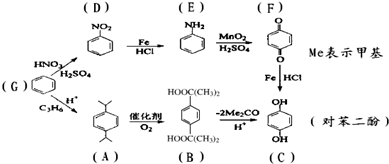

| A��G��D��D��E�ķ�Ӧ������ȡ����Ӧ |
| B��B�л����к��еĹ��������Ȼ� |
| C��G��A��A��B��������Ӧ����������ԭ�ӱ�100%���� |
| D���Ա����ӿ��Է���ȡ�����ӳɡ���ԭ�����������ۺ�ˮ�ⷴӦ |
����ʱ0.1mol?L-1 HA��Һ��pH��1��0.1mol?L-1 BOH��Һ��c��OH-����c��H+��=1012��������Һ�������ϣ������ж���ȷ���ǣ�������
| A��c��OH-����c��H+����c��B+����c��A-�� |
| B��c��OH-��=c��H+��+c��HA�� |
| C��c��H+��+c��B+����c��A-��+c��OH-�� |
| D��c��A-��=c��B+����c��H+��=c��OH-�� |
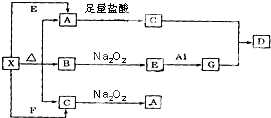 ��ͼ��ʾ�ķ�Ӧ��ϵ�У����ֲ��ﱻ��ȥ����֪��ɫ�����ĩX���ȷֽ⣬�ָ����������ɰ�ɫ����A����ɫҺ��B����ɫ����C��X��E��G����ɫ��Ӧ��Ϊ��ɫ��DΪ��ɫ������
��ͼ��ʾ�ķ�Ӧ��ϵ�У����ֲ��ﱻ��ȥ����֪��ɫ�����ĩX���ȷֽ⣬�ָ����������ɰ�ɫ����A����ɫҺ��B����ɫ����C��X��E��G����ɫ��Ӧ��Ϊ��ɫ��DΪ��ɫ������