题目内容
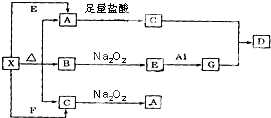 如图表示的反应关系中,部分产物被略去.已知白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C.X、E、G的焰色反应均为黄色,D为白色沉淀.
如图表示的反应关系中,部分产物被略去.已知白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C.X、E、G的焰色反应均为黄色,D为白色沉淀.回答下列问题:
(1)写出下列物质的化学式:B
(2)写出C和Na2O2化学方程式:
(3)写出E和Al反应的化学方程式:
(4)写出X与E反应的离子方程式:
考点:无机物的推断
专题:推断题
分析:X、E、G的焰色反应均为黄色,都含有Na元素;X分解生成无色液体B,故B为H2O,可知E为NaOH,G为NaAlO2;无色气体C与Na2O2反应生成白色固体A,C为CO2,则A是Na2CO3,CO2+NaAlO2→D,则D为Al(OH)3.则X为NaHCO3,NaHCO3+F→CO2,F可以是酸或铝盐等,以此解答该题.
解答:
解:X、E、G的焰色反应均为黄色,都含有Na元素;X分解生成无色液体B,故B为H2O,可知E为NaOH,G为NaAlO2;无色气体C与Na2O2反应生成白色固体A,C为CO2,则A是Na2CO3,CO2+NaAlO2→D,则D为Al(OH)3.则X为NaHCO3,NaHCO3+F→CO2,F可以是酸或铝盐等,
(1)由以上分析可知B为H2O,D为Al(OH)3,故答案为:H2O;Al(OH)3;
(2)C为CO2,与过氧化钠反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)E为NaOH,和铝反应生成偏铝酸钠和氢气,反应的化学方程式为2NaOH+2Al+2H2O=2NaAlO2+3H2↑,故答案为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑;
(4)X+E→A是NaHCO3与NaOH反应生成Na2CO3、H2O,反应离子方程式为:HCO3-+OH-=CO32-+H2O,故答案为:HCO3-+OH-=CO32-+H2O.
(1)由以上分析可知B为H2O,D为Al(OH)3,故答案为:H2O;Al(OH)3;
(2)C为CO2,与过氧化钠反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)E为NaOH,和铝反应生成偏铝酸钠和氢气,反应的化学方程式为2NaOH+2Al+2H2O=2NaAlO2+3H2↑,故答案为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑;
(4)X+E→A是NaHCO3与NaOH反应生成Na2CO3、H2O,反应离子方程式为:HCO3-+OH-=CO32-+H2O,故答案为:HCO3-+OH-=CO32-+H2O.
点评:本题以无机框图题的形式考查无机物推断,涉及Na、Al等元素单质及化合物的相互转化关系,“无色液体B,X、E、G的焰色反应均为黄色”等是解题突破口,结合气体C与Na2O2反应利用顺推法与逆推法进行推断,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将下列物质按酸、碱、盐分类排列,正确的是( )
| A、硫酸、纯碱、CaSO4 |
| B、HCl、烧碱、CuSO4 |
| C、HNO3、乙醇、氯化钠 |
| D、碳酸、CaO、苛性钠 |
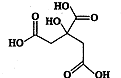 物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )| A、X的分子式为C6H7O7 |
| B、1 mol物质x最多可以和3 mol氢气发生加成反应 |
| C、X分子内所有原子均在同一平面内 |
| D、足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同 |
将100g CaCO3与一定量SiO2在高温下充分反应,产生的气体在标况下的体积为( )
| A、22.4㎡ |
| B、22.4L |
| C、11.2L |
| D、2.24L |
 化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂.
化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂. 2007年诺贝尔化学奖授予德国科学家格哈德?埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献.
2007年诺贝尔化学奖授予德国科学家格哈德?埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献. 科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示. 与
与
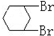 与
与
 与
与
 与
与
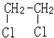 与CH3-CH2Cl
与CH3-CH2Cl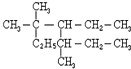 是某有机物结构简式,按系统命名法,该有机物的命名正确的是
是某有机物结构简式,按系统命名法,该有机物的命名正确的是