题目内容
下列有关说法正确的是( )
| A、室温下,反应CaCO3(s)═CaO(s)+CO2(g)不能自发进行,说明该反应的△H>0、△S<0 |
| B、饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变 |
| C、Na2CO3溶液加水稀释后,恢复至原温度,溶液pH和Kw均减小 |
| D、在0.l mol?L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1 |
考点:反应热和焓变,水的电离
专题:化学反应中的能量变化,电离平衡与溶液的pH专题
分析:A、据焓变和熵变的概念分析;
B、溶液为饱和溶液,氢氧根离子浓度不变;
C、Kw只受温度影响;
D、加水太多接近中性后,再加水氢离子浓度几乎不变.
B、溶液为饱和溶液,氢氧根离子浓度不变;
C、Kw只受温度影响;
D、加水太多接近中性后,再加水氢离子浓度几乎不变.
解答:
解:A、反应CaCO3(s)═CaO(s)+CO2(g)中,△H>0、△S>0,则△H-T△S>0时反应不能自发进行,不能说明△H>0、△S<0,故A错误;
B、溶液为饱和溶液,温度不变时浓度不变,所以氢氧根离子浓度不变,pH不变,故B正确;
C、Kw只受温度影响,温度不变时Kw不变,故C错误;
D、加水太多接近中性后,再加水氢离子浓度几乎不变,而硫酸根浓度减小,故D错误;
故选B.
B、溶液为饱和溶液,温度不变时浓度不变,所以氢氧根离子浓度不变,pH不变,故B正确;
C、Kw只受温度影响,温度不变时Kw不变,故C错误;
D、加水太多接近中性后,再加水氢离子浓度几乎不变,而硫酸根浓度减小,故D错误;
故选B.
点评:本题考查了反应自发进行的条件、饱和溶液、水的离子积常数等等,题目难度不大.

练习册系列答案
相关题目
如表为元素周期表中短周期的一部分,下列说法正确的是( )
| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
| A、①~⑥一定全部是非金属元素 |
| B、对应单质的活泼性:②>③ |
| C、④的最高价氧化物对应的水化物可能为两性物质 |
| D、②、⑤的最高价氧化物对应的水化物可能均为强酸 |
煤化工的产品很多,如合成气(CO、H2)、甲醇等对煤炭工业转型具有重要意义.下列说法不正确的是( )
| A、煤转化为气态燃料,可以降低碳的排放 |
| B、甲醇的沸点是64.5℃,甲醇中的水分可采用蒸馏法分离 |
| C、工业上利用饱和的K2CO3溶液分离回收废气中的CO2,符合低碳经济理念 |
| D、采用内衬聚四氟乙烯的钢管输送合成气,可有效减缓钢管的腐蚀 |
科学家已经合成出氧的一种单质O4,下列关于该物质的说法正确的是( )
| A、摩尔质量是64g |
| B、是氧的一种同位素 |
| C、分子中含有离子键 |
| D、是氧的一种同素异形体 |
设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A、100mL 3mol/L盐酸与5.6g Fe充分反应转移0.3NA个电子 |
| B、标准状况下,22.4L乙醇中含有的碳原子数目为2NA个 |
| C、16g O2和O3的混合物中含有的氧原子数目为NA个 |
| D、0.05mol熔融的CaCl2中含有0.1NA个阳离子 |
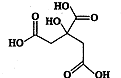 物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )| A、X的分子式为C6H7O7 |
| B、1 mol物质x最多可以和3 mol氢气发生加成反应 |
| C、X分子内所有原子均在同一平面内 |
| D、足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同 |
卫星发射时可用肼(N2H4)为燃料,1mol气态肼在适量氧气中燃烧,生成氮气和水蒸气,放出534KJ的热量.下列说法中正确的是( )
| A、1mol N2H4 (g)的能量比1molN2(g)的能量高534KJ |
| B、1mol N2H4 (g)的能量比1molN2(g)的能量低534KJ |
| C、1mol N2H4 (g)与1molO2(g)的总能量和比1molN2(g)和2molH2O(g)的总能量和高534KJ |
| D、1mol N2H4 (g)与1molO2(g)的总能量和比1molN2(g)和2molH2O(g)的总能量和低534KJ |
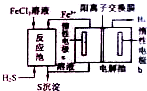 化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂.
化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂. 化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下:
化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下: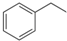 (g)?
(g)?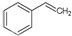 (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol.