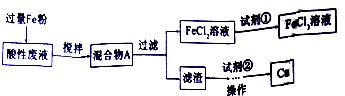
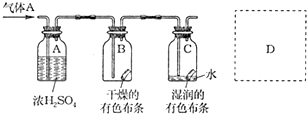
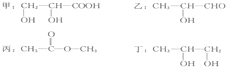题目内容
常温时0.1mol?L-1 HA溶液的pH>1,0.1mol?L-1 BOH溶液中c(OH-):c(H+)=1012,将两溶液等体积混合,以下判断正确的是( )
| A、c(OH-)<c(H+)<c(B+)<c(A-) |
| B、c(OH-)=c(H+)+c(HA) |
| C、c(H+)+c(B+)<c(A-)+c(OH-) |
| D、c(A-)=c(B+)>c(H+)=c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:常温下,0.1mol/L的酸HA溶液的pH>1,说明HA不完全电离为弱电解质,0.1mol/L的碱BOH溶液中c(OH-):c(H+)=1012,c(OH-).c(H+)=10-14,则c(OH-)=0.1mol/L,则BOH完全电离为强碱,将两溶液等体积混合,二者恰好反应生成强碱弱酸盐,溶液溶液呈碱性.
解答:
解:A、将两溶液等体积混合,二者恰好反应生成强碱弱酸盐,溶液溶液呈碱性,所以离子浓度大小为:c(H+)<c(OH-)<c(A-)<c(B+),故A错误;
B、根据质子守恒可知:c(OH-)=c(H+)+c(HA),故B正确;
C、电荷守恒,可知c(H+)+c(B+)=c(A-)+c(OH-),故C错误;
D、二者恰好反应生成强碱弱酸盐,溶液溶液呈碱性,所以离子浓度大小为:c(H+)<c(OH-)<c(A-)<c(B+),故D错误;
故选B.
B、根据质子守恒可知:c(OH-)=c(H+)+c(HA),故B正确;
C、电荷守恒,可知c(H+)+c(B+)=c(A-)+c(OH-),故C错误;
D、二者恰好反应生成强碱弱酸盐,溶液溶液呈碱性,所以离子浓度大小为:c(H+)<c(OH-)<c(A-)<c(B+),故D错误;
故选B.
点评:本题考查了酸碱混合溶液定性判断,根据酸碱电离程度确定酸碱的强弱是解本题关键,再根据二者反应生成盐的性质来分析解答,难度中等.

练习册系列答案
相关题目
鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )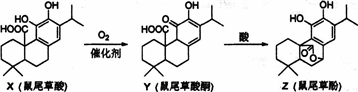

| A、X、Y、Z互为同系物 |
| B、X、Y、Z均能与FeCl3溶液发生显色反应 |
| C、1molZ与NaOH溶液反应最多消耗3molNaOH |
| D、1molY与浓溴水反应最多消耗3molBr2 |
设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A、100mL 3mol/L盐酸与5.6g Fe充分反应转移0.3NA个电子 |
| B、标准状况下,22.4L乙醇中含有的碳原子数目为2NA个 |
| C、16g O2和O3的混合物中含有的氧原子数目为NA个 |
| D、0.05mol熔融的CaCl2中含有0.1NA个阳离子 |
卫星发射时可用肼(N2H4)为燃料,1mol气态肼在适量氧气中燃烧,生成氮气和水蒸气,放出534KJ的热量.下列说法中正确的是( )
| A、1mol N2H4 (g)的能量比1molN2(g)的能量高534KJ |
| B、1mol N2H4 (g)的能量比1molN2(g)的能量低534KJ |
| C、1mol N2H4 (g)与1molO2(g)的总能量和比1molN2(g)和2molH2O(g)的总能量和高534KJ |
| D、1mol N2H4 (g)与1molO2(g)的总能量和比1molN2(g)和2molH2O(g)的总能量和低534KJ |
近期,世界范围内有成千上万个湖泊变为鱼类绝迹的死湖,数以千万公顷计的森林衰败枯萎,大片土地沙漠化…将这些现象与频繁降落的酸雨相联系,人们认为,酸雨是肇事主因.某研究小组研究某地硫酸酸雨的形成,有人提出以下猜想:
猜想一:SO2
SO3
H2SO4
猜想二:S02
H2SO3
H2SO4
猜想三:以上两过程同时存在
有关上述猜想,收集一定量该地区刚下的雨水进行实验,下列判断中错误的是( )
猜想一:SO2
| 氧化 |
| 雨水 |
猜想二:S02
| 雨水 |
| 氧化 |
猜想三:以上两过程同时存在
有关上述猜想,收集一定量该地区刚下的雨水进行实验,下列判断中错误的是( )
| A、若猜想一或猜想三正确,则该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成 |
| B、若存在猜想二的过程,则该雨水可能使品红褪色 |
| C、若只存在猜想一的过程,则该雨水的pH随时间延长而增大 |
| D、上述任意一个猜想正确,该地区雨水的pH均小于5.6 |
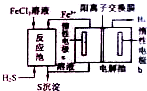 化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂.
化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂.