题目内容
4.合成氨工业生产中所用的α-Fe催化剂的成分为FeO、Fe2O3.(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中二价铁与三价铁的物质的量之比为1:1.
(2)当催化剂中二价铁与三价铁的物质的量之比为1:2时,其催化活性最高,此时该催化剂中铁的质量分数为0.072(用小数表示,精确到0.01).
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生反应:2Fe2O3+C$\stackrel{高温}{→}$4FeO+CO2↑.为制得这种活性最高的催化剂,应向320g Fe2O3粉末中加入炭粉的质量为4g,生成实验条件下CO2的体积为8L(假设此实验条件下,气体摩尔体积为24L/mol).
分析 (1)设出FeO、Fe2O3的物质的量,然后根据“铁、氧的物质的量之比为4:5”列式计算出二者的物质的量之比,然后计算出二价铁与三价铁的物质的量之比;
(2)根据“二价铁与三价铁的物质的量之比为1:2”计算出FeO、Fe2O3的物质的量物质的量之比,然后计算出该催化剂中铁的质量分数;
(3)根据n=$\frac{m}{M}$计算320g Fe2O3 的物质的量,再根据当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,计算FeO 的物质的量,根据方程式 计算碳的物质的量、生成二氧化碳的物质的量,根据m=nM计算碳粉质量,根据V=nVm计算二氧化碳体积.
解答 解:(1)设FeO、Fe2O3的物质的量分别为x、y,铁、氧的物质的量之比为4:5,则(x+2y):(x+3y)=4:5,整理可得x:y=2:1,则二价铁与三价铁的物质的量之比为(2×1):(1×2)=1:1,
故答案为:1:1;
(2)当催化剂中二价铁与三价铁的物质的量之比为1:2时,FeO、Fe2O3的物质的量物质的量之比=1:(2×$\frac{1}{2}$)=1:1,则该催化剂中铁的质量分数为:$\frac{56×(1+2)}{72+160}$≈0.072,
故答案为:0.72;
(3)320g Fe2O3 的物质的量为:$\frac{320g}{160g/mol}$=2mol,根据当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,则FeO为2mol×2×$\frac{1}{3}$=$\frac{4}{3}$mol,
2Fe2O3+C$\stackrel{高温}{→}$4FeO+CO2↑
1 4 1
n(C) $\frac{4}{3}$mol n(CO2)
n(C)=n(CO2)=$\frac{\frac{4}{3}mol×1}{4}$=$\frac{1}{3}$mol,
故m(C)=$\frac{1}{3}$mol×12g/mol=4g,
该条件下V(CO2)=$\frac{1}{3}$mol×24gL/mol=8L
故答案为:4;8L.
点评 本题考查物质的量的计算、混合物计算,属于拼合型题目,侧重考查学生分析解决问题的能力,注意掌握物质的量与气体摩尔体积、摩尔质量等之间的关系.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| A. | 浓的强酸和稀的强碱反应 | B. | 浓的弱酸和稀的强碱反应 | ||
| C. | 等浓度的强酸和弱碱反应 | D. | 稀的强酸和浓的弱碱反应 |
| A. | 某酸性溶液中可能大量存在:NH4+、Fe3+、NO3-、I- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液中,Al3+、Cl-、Ba2+、NO3-一定不能大量共存 | |
| C. | 向NH3•H2O溶液中滴加少量AlCl3溶液,发生反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向含有1 mol FeBr2的水溶液中通入标准状况下11.2 L Cl2,发生反应:Cl2+2Fe2+═2Fe3++2Cl- |
| A. | 常温常压下,32g03含有的氧原子数为2NA | |
| B. | 常温常压下,22.4LCH4含有的分子数为NA | |
| C. | 1Llmol•L-1CaCl2溶液中含有的Cl-数为NA | |
| D. | 1molZn变为Zn2+时失去的电子数为NA |
| A. | NaCl=Na++Cl- | B. | H2SO4=2H++SO42- | ||
| C. | Ca(OH)2=Ca2++2OH- | D. | Al2(SO4)3=Al3++SO42- |
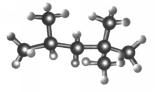 “辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )
“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )| A. | 1,1,3,3-四甲基丁烷 | B. | 2,2,4-甲基庚烷 | ||
| C. | 2,4,4-三甲基戊烷 | D. | 2,2,4-三甲基戊烷 |
 .
.
 .
. .
.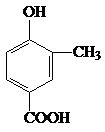 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.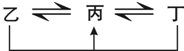 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: .
.