题目内容
12.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.已知:①Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O;
②2SO2+SeO2+2H2O═Se+2SO42-+4H+.
(1)依据Se与浓H2SO4反应写出Se和浓HNO3(还原产物为NO2)反应的化学方程式:Se+4HNO3(浓)═SeO2+4NO2↑+2H2O.
(2)Se与浓HNO3的反应中,氧化剂是浓HNO3,还原剂是Se,反应中被还原的元素是N.当有标准状况下22.4L NO2气体生成时,转移电子的物质的量是1 mol.
(3)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是浓硫酸>SeO2>SO2.
(4)用双线桥法标出反应②电子转移的方向和数目:
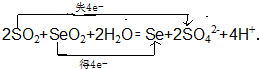 .
.(5)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O
配平上述反应的化学方程式.SeO2+4KI+4HNO3═Se+2I2+4KNO3+2H2O.
分析 (1)依据Se与浓H2SO4的反应可知,Se和浓HNO3反应生成SeO2和NO2和水;
(2)在反应Se+4HNO3(浓)═SeO2+4NO2↑+2H2O中,Se的化合价升高被氧化,浓硝酸化合价降低被还原,此反应转移4mol电子,生成3mol二氧化氮气体;
(3)反应中,氧化剂的氧化性强于氧化产物的氧化性,氧化剂的氧化性强于还原剂的氧化性,据此分析;
(4)反应②中,2molSO2共失去4mol电子,失去的电子被SeO2得到,从而被还原为Se;
(5)在反应SeO2+KI+HNO3→Se+I2+KNO3+H2O中,SeO2得4个电子,而KI失1个电子,根据得失电子数守恒并结合质量守恒来分析.
解答 解:(1)依据Se与浓H2SO4的反应可知,Se和浓HNO3反应生成SeO2和NO2和水,根据得失电子数守恒配平可得:Se+4HNO3(浓)═SeO2+4NO2↑+2H2O,故答案为:Se+4HNO3(浓)═SeO2+4NO2↑+2H2O;
(2)在反应Se+4HNO3(浓)═SeO2+4NO2↑+2H2O中,Se的化合价升高被氧化,做还原剂,浓硝酸化合价降低被还原,做氧化剂,反应中N元素化合价降低被还原,此反应转移4mol电子,生成4mol二氧化氮气体,故当生成标况下22.4L二氧化氮气体时,转移1mol电子,故答案为:浓HNO3;Se;N;1;
(3)反应①Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O中,浓硫酸做氧化剂,SeO2是氧化产物,故氧化性:浓硫酸>SeO2;
在反应②2SO2+SeO2+2H2O═Se+2SO42-+4H+中,SeO2做氧化剂,SO2是还原剂,故氧化性:SeO2>SO2.故可知氧化性:浓硫酸>SeO2>SO2;
故答案为:浓硫酸>SeO2>SO2;
(4)反应②中,2molSO2共失去4mol电子,失去的电子被SeO2得到,从而被还原为Se,故此反应转移4mol电子,用双线桥法标出得失电子数可有: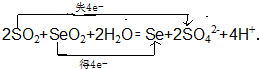 ,故答案为:
,故答案为: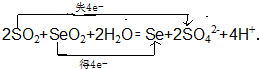 ;
;
(5)在反应SeO2+KI+HNO3→Se+I2+KNO3+H2O中,SeO2得4个电子,而KI失1个电子,根据得失电子数守恒可知,SeO2的计量数为1,而KI的计量数为4,故Se的计量数为1,I2的计量数为2,根据质量守恒可知,KNO3的计量数为4,则HNO3的计量数为4,水的计量数为2,故方程式为:SeO2+4KI+4HNO3═Se+2I2+4KNO3+2H2O,故答案为:SeO2+4KI+4HNO3═Se+2I2+4KNO3+2H2O.
点评 本题考查氧化还原反应有关知识,涉及氧化性强弱比较、氧化还原反应配平、电子转移表示、氧化还原反应滴定计算等,难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA | |
| B. | 0.1 mol羟基( )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 0.1 mol•L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1 NA | |
| D. | 在精炼铜或电镀铜的过程中,当阴极析出铜32g,转移电子数均为NA |
| A. | 乙醇不能发生氧化反应 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 由乙酸和乙醇制乙酸乙酯与由苯制取硝基苯反应属于同一类型的反应 | |
| D. | 苯和乙烷都能发生加成反应 |
| A. | O2和O3 | B. | CH3CH2CH2CH3和 | C. | 12C和13C | D. | CH4和CH3CH3 |
| A. | 16mo1 | B. | 19 mol | C. | 20mol | D. | 23mol |
| A. | 2-乙基戊烷 | B. | 2,2-二氯丁烷 | ||
| C. | 2,2-二甲基-3-己醇 | D. | 3,4-二甲基戊烷 |