题目内容
9.下列电离方程式错误的是( )| A. | NaCl=Na++Cl- | B. | H2SO4=2H++SO42- | ||
| C. | Ca(OH)2=Ca2++2OH- | D. | Al2(SO4)3=Al3++SO42- |
分析 A.氯化钠为强电解质,在溶液中完全电离出钠离子和氯离子;
B.硫酸为强酸,在溶液中完全电离出氢离子和硫酸根离子;
C.氢氧化钙为强电解质,在溶液中完全电离;
D.电离方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.NaCl在溶液中完全电离出钠离子和氯离子,电离方程式为:NaCl=Na++Cl-,故A正确;
B.硫酸为二元强酸,其电离方程式为:H2SO4=2H++SO42-,故B正确;
C.氢氧化钙在溶液中完全电离,其电离方程式为:Ca(OH)2=Ca2++2OH-,故C正确;
D.硫酸铝在溶液中完全电离出铝离子和硫酸根离子,正确的电离方程式为:Al2(SO4)3=2Al3++3SO42-,故D错误;
故选D.
点评 本题考查了电离方程式的书写方法判断,题目难度不大,正确判断强弱电解质为解答关键,注意掌握电离方程式的书写原则,试题侧重基础知识的考查,有利于培养学生的灵活应用能力.

练习册系列答案
相关题目
17.某种中和胃酸的药物主要成分的化学式为Al2Mg6(OH)16CO3•4H2O.1molAl2Mg6(OH)16CO3•4H2O中,氧原子的物质的量为( )
| A. | 16mo1 | B. | 19 mol | C. | 20mol | D. | 23mol |
3.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是2,5,5-三甲基-3-乙基庚烷 的名称是2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将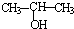 与NaOH的醇溶液共热可制备CH3-CH═CH2 与NaOH的醇溶液共热可制备CH3-CH═CH2 | |
| C. | 向柠檬醛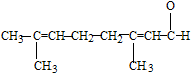 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 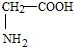 、 、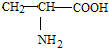 、 、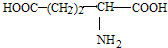 三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 |
10.下列有机物名称正确的是( )
| A. | 2-乙基戊烷 | B. | 2,2-二氯丁烷 | ||
| C. | 2,2-二甲基-3-己醇 | D. | 3,4-二甲基戊烷 |
7.下列实验操作正确的是( )
| A. | 蒸发时应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,将待过滤的物质沿玻璃棒倒入过滤器时,玻璃棒下端应靠在三层滤纸处 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一个烧杯中 | |
| D. | 蒸馏操作时,温度计应插入在溶液中 |